Матрикс соединительной ткани
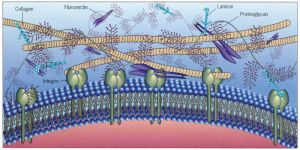
Матрикс соединительной ткани.
Молекулярная и надмолекулярная организация фибриллярных структур и основного вещества
Белки фибриллярных структур
Коллагены. Почти до конца 60-х годов прошлого века коллаген рассматривался как единый белок, общий для всех видов соединительной ткани. Однако выяснилось, что существует ряд обладающих общими признаками белков коллагеновой природы, которые принято называть типами; типы обозначают римскими цифрами. Термин «коллаген» приобрел собирательное значение. В организмах млекопитающих, включая человека, известно 27 типов коллагеновых макромолекул, которые построены из 42 различных коллагеновых полипептидов, каждый из которых является продуктом экспрессии индивидуального гена.
Коллагены 27 типов рассматриваются как суперсемейство, которое состоит из двух семейств: фибриллярных коллагенов и нефибриллярных коллагенов. Общим для обоих семейств является наличие в макромолекулах больших специфических коллагеновых доменов. Эти домены построены из полипептидных цепей, имеющих конформацию спирализованных α-цепей, состоящих из регулярно повторяющихся трипептидов, строение которых описывается формулой Гли—Xxx-Yyy, где первая позиция строго обязательно занята остатком глицина, Ххх очень часто является остатком пролина, a Yyy может быть остатком любой аминокислоты, но сравнительно часто в этой позиции находится 4-гидроксипролин (Аминокислота гидроксипролин, образующаяся путем гидроксилирования уже включенного в полипептидную цепь пролина, практически специфична для коллагенов. Благодаря этому гидроксипролин обычно служит «меткой», позволяющей проводить количественное определение коллагенов в тканях.) (до середины 70-х годов прошлого столетия в отечественной литературе употреблялось не вполне точное название «оксипролин»); все коллагеновые полипептиды содержат также различные количества гидроксилизина. В коллагеновых доменах три таких а-спирали сплетены во вторичную тройную спираль.
Различие между фибриллярными и нефибриллярными коллагенами состоит в том, что у фибриллярных непрерывный коллагеновый домен образует основную часть макромолекулы (более 90% ее длины), тогда как у нефибриллярных не столь протяженный коллагеновый домен имеет большее или меньшее число перерывов, заполненных неколлагеновыми доменами. Небольшие неколлагеновые домены есть и у фибриллярных коллагенов; они располагаются по обоим концам центрального коллагенового домена и называются телопептидами. Неколлагеновые домены не обладают аминокислотным составом, свойственным коллагеновым доменам, и, соответственно, имеют другую пространственную конформацию.
Из числа фибриллярных коллагенов наибольшую массу (поэтому они и называются «большими») составляют открытые раньше других «классические» коллагены I, II и III типов. Их макромолекулы соединяются в фибриллы, у которых при электронно-микроскопическом исследовании выявляется характерная регулярная поперечная исчерченность; фибриллы объединяются в волокна различного диаметра, а волокна, в свою очередь, формируют пучки волокон. Структурная и механическая стабильность макромолекул, фибрилл и волокон обеспечивается развитой системой внутри- и межмолекулярных поперечных связей, в образование которых, как правило, вовлечены неколлагеновые тело-пептиды. Остальные фибриллярные коллагены (V, XI типов) построены по тому же принципу, но они не образуют самостоятельных фибрилл, а входят в небольших количествах в структуру фибрилл, сформированных из больших коллагенов.
Более многочисленные нефибриллярные коллагены, объединяемые в несколько подсемейств, как показывает их название, образуют не фибриллы и волокна, а другие надмолекулярные структуры — микрофиламенты (например, коллагены VI и VII типов), сетчатые структуры (коллагены IV и X типов) и некоторые другие. Этим структурам также принадлежит определенная биомеханическая роль в организации внеклеточного соединительного матрикса и в его взаимосвязях с клетками.
Коллагены, присутствующие в образующих сустав тканях, будут рассмотрены подробнее в соответствующих главах.
Закономерности биосинтеза коллагенов полностью совпадают с общими закономерностями биосинтеза белков, излагаемыми в руководствах по клеточной и молекулярной биологии.
Они наиболее детально изучены на примере биосинтеза α1-цепи коллагена I типа. Первоначально синтезируется препроколлагеновый полипептид с очень длинной сигнальной последовательностью (100 аминокислотных остатков). В дальнейшем осуществляется сложный ряд посттрансляционных модификаций, которые при участии соответствующих ферментов происходят как внутриклеточно (гидроксилирование остатков пролина и лизина, гликозилирование некоторых остатков гидроксилизина, образование тройной спирали и внутримолекулярных поперечных связей), так и во внеклеточном матриксе (отщепление неспирализованных N- и С-концевых пептидов про-коллагена, сборка фибрилл, образование межмолекулярных поперечных связей).
Эластические волокна. В матриксе соединительной ткани тех органов, функция которых связана со способностью к обратимому растяжению, т.е. с эластичностью (речь идет в первую очередь об артериальных сосудах, легких и коже), важная биомеханическая роль принадлежит эластическим волокнам, которые в небольшом количестве содержатся также в фиброзной и синовиальной оболочках капсулы.
При ТЭМ в эластических волокнах выявляются аморфный (не имеющий таких внешних признаков структурности, как, например, поперечная исчерченность коллагенов) и фибриллярный компоненты. Аморфный компонент, составляющий более 90% массы волокон и образующий их сердцевину, — это специфический для этих волокон белок — эластин. Фибриллярный компонент состоит из очень тонких (диаметром 10—12 нм) микрофибрилл, отличающихся от упоминавшихся выше коллагеновых микрофиламентов. Микрофибриллы образуют каркас, в который «упакована» аморфная масса эластина. Эти микрофибриллы будут далее рассмотрены отдельно.
Эластин — один из немногочисленных в природе эластомерных белков, которые характеризуются упругостью, способностью подвергаться значительному растяжению с последующим возвращением в исходное расслабленное состояние, причем это возвращение не требует дополнительных затрат энергии.
В синтетических пептидах, моделирующих фрагменты макромолекулы эластина, наряду с участками, имеющими конформацию жесткой а-спирали, имеются и длинные участки (в сумме они составляют около 85% длины макромолекулы), представляющие собой p-спираль, которая может растягиваться наподобие пружины с разрывом водородных связей между витками. Длина каждого такого растяжимого участка не может превышать расстояния между двумя ближайшими друг к другу ковалентными поперечными связями; проведенные расчеты показали, что это расстояние составляет в среднем 70 аминокислотных остатков, а молекулярная масса такого участка равна примерно 6 кДа.
Для эластина специфичны поперечные связи между полипептидными цепями, названные десмозинами (известно 4 десмозина — десмозин, изодесмозин, меродесмозин и дегидромеродесмозин). Анализ показал, что они представляют собой тетракарбоксильные тетрааминокислоты. Благодаря такому строению каждая из этих аминокислот может одновременно входить в состав нескольких (до 4 включительно) полипептидных цепей.
Эластин синтезируется в виде растворимого предшественника, молекула которого — тропоэластин — обладает мол. м. около 70 кДа и содержит примерно 750 аминокислотных остатков. Посттрансляционные модификации, в частности образование десмозинов во внеклеточном матриксе, очень скоро превращают тропоэластин в нерастворимый эластин.
Иммуноэлектронно-микроскопические исследования выявили во многих тканях микрофибриллы, морфологически сходные с микрофибриллами эластических волокон, но расположенных вне этих волокон. Такие микрофибриллы, обладающие некоторой эластичностью, хотя и уступающей упругости эластических волокон, найдены и в тканях, в которых эластические волокна полностью отсутствуют (костная ткань, ткань печени и почек, ткани глаза). Микрофибриллы — филогенетически более древнее образование, чем эластические волокна, функция которых, очевидно, заключается в обеспечении минимальной эластичности лишенных эластина тканей. Складывается мнение, что микрофибриллы представляют собой самостоятельную, третью наряду с коллагеновыми и эластическими волокнами, волокнистую систему экстрацеллюлярного матрикса соединительной ткани. Важным дополнительным доводом в пользу этой точки зрения служит открытие микрофибриллопатий — отдельных генетически обусловленных нозологических единиц, не совпадающих с мутационными изменениями эластических волокон. Нередко наблюдаемая у людей микрофибриллопатия называется синдромом Марфана, сопровождаемом выраженными деформациями скелета.
Основным материалом, из которого построены микрофибриллы, является гликопротеин фибриллин с мол. м. около 350 кДа. Фибриллин известен в двух изоформах. Установлено, что очень длинная гибкая полипептидная цепь одной из изоформ — фибриллина-1 — состоит из 2871 аминокислотного остатка и носит сложный мультидоменный характер.
В состав микрофибрилл, помимо фибриллинов, входит еще несколько гликопротеинов, необходимых для обеспечения их структурной целостности; кроме того, они содержат связанный кальций. Фибриллины и другие макромолекулярные компоненты микрофибрилл экспрессируются фибробластами и их аналогами, в частности остеобластами. Сборка микрофибрилл происходит в экстрацеллюлярном матриксе.
Углеводно-белковые полимеры интерфибриллярной субстанции
Протеогликаны, занимающие в некоторых разновидностях соединительной ткани, например в хряще, основную часть объема интерфибриллярной субстанции матрикса, представляют собой комплексные макромолекулы — они состоят из белка (его называют стержневым) и полимерных линейных углеводов — гликозаминогликанов.
Все гликозаминогликаны соединительной ткани позвоночных — это неразветвленные, иногда очень длинные полисахариды, построенные из повторяющихся дисахаридных единиц. Каждая дисахаридная единица состоит из моноз: N-ацетилированного гексозамина (глюкозамина или галактозамина) и гексуроновой кислоты (D-глюкуроновой или L-индуроновой). В кератансульфате место гексуроновой кислоты занимает галактоза. Все гликозаминогликаны, кроме гиалуронана, который мы рассмотрим отдельно, содержат присоединенные сульфатные группы.
Монозы, входящие в состав дисахаридных единиц, обладают выраженной гетерогенностью, которая делает весьма разнообразными гликозаминогликаны в различных тканях и на разных стадиях онтогенеза.
Функции гликозаминогликанов определяются их анионным характером, обусловленным присутствием сульфатных групп, и их способностью образовывать стабильные вторичные и третичные структуры, которые важны для архитектоники матрикса. Но, вопреки распространенному еще недавно мнению, главная функциональная роль в макромолекулах большинства протеогликанов принадлежит не гликозаминогликанам, а стержневым белкам. Последние обладают сложным доменным строением и активно участвуют в формировании супрамолекулярной организации матрикса, взаимодействия с другими его компонентами и клетками.
Стержневые белки протеогликанов весьма разнообразны по строению и размерам: их мол. м. колеблется от 11 до 370 кДа. Некоторые стержневые белки содержат присоединенные олигосахаридные группы, т.е. представляют собой гликопротеины. Помимо доменов, предназначенных для связывания гликозаминогликанов, молекулы большинства стержневых белков располагают также доменами для связывания с молекулами коллагенов, структурных гликопротеинов, а также с мембранами клеток.
С прагматической точки зрения суперсемейство протеогликанов (их известно не менее 80) целесообразно классифицировать по их локализации в тканях. Выделяют следующие семейства:
- протеогликаны внеклеточного матрикса; этот класс подразделяется в зависимости от молекулярной массы их белков на «большие» и «малые» протеогликаны;
- протеогликаны базальных мембран;
- протеогликаны клеточных мембран (плазмолеммы), которые активно участвуют во взаимодействии клеток и матрикса;
- внутриклеточные протеогликаны, содержащиеся обычно в секреторных гранулах.
Особое место в суперсемействе гликозаминогликанов занимает гиалуронан. Это название сменило распространенное ранее название «гиалуроновая кислота», поскольку in vivo эта макромолекула присутствует не в виде кислоты, а в виде полианиона. Гиалуронан не входит в состав макромолекул ни одного из протеогликанов, не образует ковалентных связей с белками и не подвергается сульфатированию. Дисахарид, из которого построен гиалуронан (называемый гиалобиуроновой кислотой), состоит из остатков глюкуроновой кислоты и N-ацетилглюкозамина. Число таких дисахаридов в одной макромолекуле достигает 10 тыс. и более; соответственно, молекулярная масса гиалуронана может превышать 4000 кДа. В связи с тем что длина одного дисахарида примерно равна 1 нм, длина макромолекулы гиалуронана в растянутом состоянии равна около 10 мкм, что сопоставимо, например, с диаметром эритроцита.
Биосинтез протеогликанов осуществляется в два этапа. На первом этапе происходит синтез стержневого белка в соответствии с общими закономерностями матричного синтеза. На втором этапе происходит сборка молекул гликозаминогликанов путем последовательного присоединения к соответствующим локусам полипептидной цепи белка углеводных мономеров. В процессе этой сборки действует система гликозилтрансфераз, переносящих моносахариды с их доноров — уридиндифосфонуклеотидов. Завершается процесс сульфатированием гликозаминогликанов специфическими сульфотрансферазами.
Гликопротеины отличаются от протеогликанов тем, что углеводные компоненты этих гликоконъюгатов представлены не гликозаминогликанами, а разветвленными олигосахаридными группами, не содержащими уроновых кислот. Практически все белки, секретируемые клетками, или, иначе говоря, все белки экстрацеллюлярного матрикса являются гликопротеинами (в том числе и протеогликаны, которые, как мы видели, помимо гликозаминогликанов, содержат олигосахариды), поэтому число гликопротеинов очень велико.
Адгезивные -это определение означает, что они обладают «липкостью», т.е. способностью легко связываться с клетками и другими компонентами матрикса, однако наличие адгезивных свойств не означает, что функции этих гликопротеинов ограничиваются решением структурных задач. Более того, функции одного и того же гликопротеина могут быть принципиально различными в разных тканях. Адгезивные молекулы при определенных условиях могут приобретать антиадгезивную активность; антиадгезивные молекулы также иногда приобретают противоположные свойства. Такая многосторонность функций гликопротеинов матрикса привела к выделению особой группы гликопротеинов (в нее входят тромбо-спондины-1 и -2, SPARC, тенасцины-С и -X, остеопонтин), названых матрицеллюлярными белками. Матрицеллюлярные белки выступают в качестве регуляторов (модуляторов) функций клеток, причем их адгезивность отступает на второй план.
Свойство адгезивности весьма отчетливо выражено у фибро-нектинов. Главная функция гликопротеинов этого семейства (или класса) — связывание клеток с разнообразными, в первую очередь фибриллярными, компонентами экстрацеллюлярного матрикса. Это отражено в их наименовании (лат. fibra — «волокно», necto — «связывать»). Образно их называют также «молекулярными клеями». Лигандами для фибронектинов служат коллагены, протеогликаны, фибрин, рецепторы клеточных мембран. Образование связей с лигандами происходит, как правило, при участии тетрапептида Арг-Гли-Асп-Сер (RGDS), который является одним из вариантов общей для большинства адгезивных белков адгезивной аминокислотной последовательности (RGD).
Экспрессируемые клетками vitro макромолекулы фибронектинов полимеризуются и подвергаются самосборке, организуясь в фибриллярную сеть. Эта сеть играет роль первичного каркаса (своего рода «строительных лесов»), необходимого для упорядоченного пространственного расположения клеток и фибриллярных структур.
Тенасцины — группа гигантских гликопротеиновых молекул, состоящих из 6 ветвей, каждая имеет мол. м. 190-250 кДа (их шестичленность выражена в другом названии — гексабрахионы). У позвоночных есть по меньшей мере 5 генов, экспрессирующих 5 изоформ тенасцинов: тенасцин-С, тенасцин-R, тенасцин-W, тенасцин-Х и тенасцин-Y. Тенасцины интенсивно экспрессируются в эмбриональных тканях, в грануляционно-фиброзной ткани заживающих ран, в строме опухолей. Это позволяет предположить участие тенасцинов в росте и развитии соединительной ткани. Молекулы тенасцинов обладают выраженными растяжимостью и эластичностью и могут, следовательно, преобразовывать действующие на клетку механические сигналы в механохимические свойства экстрацеллюлярного матрикса.
Витронектин (название произведено от лат. vitrum — «стекло», другое название — белок S) — белок мол. м. 75 кДа, присутствующий в экстрацеллюлярном матриксе и в сыворотке крови, обладает выраженной адгезивностью. Витронектин, содержащийся в сыворотке крови или растворенный в изотоническом растворе хлорида натрия, выпадает в плотный осадок при соприкосновении со стеклянной или пластмассовой поверхностью пробирки. При этом происходит прикрепление к этой поверхности клетки. Эта активность объясняет название витронектина и дает основания для предположения о важной роли витронектина во взаимодействии биологических тканей с имплантируемыми в организм полимерными биоматериалами.
SPARC был открыт в костной ткани, отсюда его второе название — остеонектин (реже употребляется еще одно название — ВМ-40). В костной ткани он проявляет себя как структурный адгезивный гликопротеин, в функциональном аспекте близкий к фибронектину. В других тканях у него было обнаружено множество функций, не свойственных адгезивным белкам, но позволяющих отнести SPARC (и другие гликопротеины, составляющие с ним общее семейство) к матрицеллюлярным белкам.
Гликопротеины ламинины и нидогены играют важнейшую роль в структурной организации базальных мембран. Ламинины (их известно 12 изоформ) — крупные гетеротримерные макромолекулы, имеющие необычную крестообразную форму. Эти макромолекулы образуют сеть, которая переплетается с составляющей основу базальных мембран сетью макромолекул коллагенов IV типа. Такое переплетение повышает прочность мембран. Главные функции ламининов определяются их адгезивностью — способностью связывать клетки и модулировать их поведение: ламинины могут изменять рост, дифференциацию, жизнеспособность, морфологию и подвижность клеток. Генетически модифицированные мыши с исключенными генами ламининов (в частности, ламинина-5) погибают на очень ранней стадии эмбриогенеза вследствие нарушения сборки базальных мембран.
Нидогены, именуемые также энтактинами, — гликопротеины, активно связывающиеся как с макромолекулами коллагенов IV типа, так и с макромолекулами ламининов — способствуют дальнейшему укреплению структуры базальных мембран и повышению их роли в качестве фильтров между клетками эктодермального происхождения и матриксом соединительной ткани. Известны две изоформы нидогенов.
Присоединение олигосахаридов к гликопротеинам в процессе биосинтеза происходит после завершения сборки полипептидной цепи. При этом используются высокоэнергетические интермедиаты — моно- или дифосфатнуклеозиды моносахаридов.
При образовании гликопротеинов, несущих О-связанные олигосахариды, сахара последовательно присоединяются к полипептиду по одному, перенос каждого моносахарида катализируется особой гликозилтрансферазой, что напоминает процесс сборки гликозаминогликанов. N-связанные олигосахариды, напротив, сначала собираются в олигосахаридные заготовки («ядра»), связанные с крупными липидными молекулами. Самым распространенным из этих липидов является долихол — ненасыщенный спирт с длинной углеродной цепью (75—95 атомов углерода). Ядра к полипептидной цепи присоединяются целиком, и только после этого олигосахариды подвергаются окончательной перестройке, теряя часть моноз и присоединяя другие.
Микроархитектоника структур матрикса
Волокна. Согласно современным представлениям, микроархитектоника волокнистых структур матрикса может быть представлена следующим образом.
Уровни организации коллагеновых структур соединительной ткани. Основой для всей группы коллагеновых структур является фибриллярный белок коллаген (склеропротеин), способы агрегации которого в надмолекулярные структуры создают несколько уровней организации коллагеновых фибрилл. Молекулярный уровень организации коллагена уже описан. На надмолекулярном уровне выявляются протофибриллы и микрофибриллы. Протофибрилла представляет собой нить, на протяжении которой 5—7 молекул коллагена связаны своими деспирализованными отделами. Более сложным образованием является микрофибрилла, которая представляет собой ультрамикроагрегат коллагеновых молекул и протофибрилл. Микрофибрилла — это наименьшая структура из коллагеновых фибрилл, которую можно выявить с помощью ТЭМ.
Фибриллярный уровень организации коллагеновых структур выявляет фибриллы, представляющие собой микроагрегат микрофибрилл. Диаметр такой фибриллы колеблется от 20 до 400 нм. Фибриллы имеют спиральную форму. Описанное строение коллагеновой фибриллы является общим для соединительной ткани всех органов.
Следующим уровнем организации коллагеновых структур является волоконный уровень. Коллагеновые фибриллы могут существовать самостоятельно, но чаще всего они объединяются в волокна, которые представляют собой агрегаты, состоящие из десятков и сотен коллагеновых фибрилл. Толщина такого волокна колеблется от 0,5 до 20,0 мкм. Коллагеновые волокна имеют спиральную форму, на поперечном же срезе они выявляются как округлые уплощенные или плоские структуры.
Уровни организации эластических структур соединительной ткани. На молекулярном уровне организации четыре полипептидных цепи участвуют в образовании молекулы эластина. Такая молекула имеет глобулярную форму (диаметр 2,8 нм) и может быть выявлена при ТЭМ.
На надмолекулярном уровне молекулы эластина формируют эластиновые филаменты толщиной 3,0—3,5 нм. Последние, в свою очередь, формируют эластические микрофибриллы в виде трубчатых структур толщиной 8—10 нм, которые также выявляются при ТЭМ. На фибриллярном уровне эластиновые филаменты и микрофибриллы образуют три разновидности эластических фибрилл с разной степенью зрелости:
- эластические фибриллы, содержащие 90 % эластических филаментов и 10% эластических микрофибрилл. Такие фибриллы считаются зрелыми, и они чаще всего представлены во всех органах;
- элауниновые эластические фибриллы, в которых содержится приблизительно равное количество эластических филаментов и эластических микрофибрилл;
- окситалановые эластические фибриллы, которые построены только из эластических микрофибрилл. Первыми в процессе эластогенеза появляются окситалановые фибриллы, но они не всегда дозревают до следующей формы — элауниновых.
На волоконном уровне организации эластических структур выявляются волокна, образованные двумя или большим числом эластических фибрилл. Такие волокна имеют спиральную форму и могут ветвиться, на поперечном срезе они выявляются как цилиндрические уплощенные или плоские структуры (эластические мембраны). При взаимодействии коллагеновых и эластических фибрилл образуются смешанные виды соединительнотканных волокон.
Наконец, на тканевом уровне коллагеновые и эластические волокна формируют волокнистый остов, который является пространственным выражением сложного взаимодействия волокон и фибрилл. Последние связаны между собой основным веществом и другими элементами соединительной ткани.
Волокнистый каркас и его типы
Различают следующие типы волокнистых каркасов: ориентированный, слабоориентированный, неориентированный и смешанный. При ориентированном типе остова основная масса волокнистых структур располагается параллельно друг другу (сухожилия, связки). Коэффициент анизотропии составляет 20-50% и более. При слабоориентированном типе эта закономерность выражена в меньшей степени. Коэффициент анизотропии составляет от 7 до 20%. Тип волокнистого остова, когда структуры расположены без преимущественной ориентации (хрящ), называют неориентированным.
При смешанном типе волокнистый остов имеет слоистое строение (роговица, склера, надхрящница). При этом каждый слой такой структуры имеет свою, отличную от соседнего слоя, ориентацию волокон.
Коллагеновые волокна по соотношению P/V (Р — периметр, V— максимальный поперечный размер) классифицируются на плоские, уплощенные и цилиндрические.
При взаимодействии коллагеновых и эластических фибрилл формируются смешанные коллагено-эластические пучки. Взаимодействующие коллагено-эластические и эластические волокна и фибриллы образуют волокнистый каркас матрикса соединительной ткани, в петлях которого расположено взаимодействующее с ним межфибриллярное основное вещество преимущественно гликоконъюгатной природы.
Н.П. Омельяненко считает более целесообразным брать за классификационный признак соединительнотканного остова белковую принадлежность волокон и говорить о трех основных типах — коллагеновом, коллагеново-эластическом и эластико-коллагеновом. Во втором всегда преобладают коллагеновые волокна. В среднем ухе преобладают эластические волокна (эластический хрящ уха).
Структурная организация волокнистых компонентов соединительной ткани различной разновидности и локализации — архитектоника компонентов волокнистого остова — связана также с такими особенностями, как спиральная форма микрофибрилл и фибрилл; ветвление фибрилл и волокон, их слияние и перераспределение; наличие волокон двух групп. Одни из них ориентированы вдоль одного, преимущественного для данного вида ткани, вектора действия нагрузок. Они играют основную биомеханическую роль (эквивалентный диаметр до 20 000 нм), другие (с меньшим диаметром — до 2000 нм) располагаются перпендикулярно или под углом к первым, часто вплетаясь в них. Совокупность этих особенностей обусловливает типичную при СМ или при ТЭМ картину соединительной ткани, особенно рыхлой, где направление и векториальность трудно уловимы. Наиболее важным является, на наш взгляд, достоверность установления ориентационных закономерностей.
Кроме коллагеновых и эластических волокон, по традиции принято описывать в составе соединительной ткани ретикулярные (или ретикулиновые), а также аргирофилъные волокна. Следует отказаться от неточных терминов «ретикулиновые волокна» и «преколлагеновые волокна». Последние представляют собой коллагеновые волокна (диаметром 15—50 нм) с типичной для фибриллярных коллагенов поперечной исчерченностью, состоящие преимущественно из коллагена III типа. Их аргирофилия (способность к импрегнированию серебром) обусловлена присутствием углеводов на их поверхности. Ретикулярные волокна, как правило, ветвятся, анастомозируют, образуют сети. Они свойственны стромальным компонентам кроветворных волокон, сосочковому слою дермы кожи, а также эмбриональной и грануляционной ткани.
Завершая рассмотрение волокнистых структур матрикса соединительной ткани, следует упомянуть о встречающихся в описаниях морфологических картин элауниновых и окситалановых волокнах. Эти волокна — не что иное как разновидности эластических волокон, тинкториальные свойства которых определяются количественными и структурными соотношениями эластина и микрофибрилл. В окситалановых волокнах преобладают микрофибриллы, а эластина содержится очень мало; элауниновые же волокна наоборот содержат больше эластина, который перемешан на поверхности волокон с микрофибриллами.
Следует также еще раз упомянуть фибриллиновые микрофибриллы, образующие, как уже было отмечено выше, третью волокнистую систему внеклеточного матрикса соединительной ткани.
Основное вещество
Гелеобразная субстанция в петлях волокнистого каркаса в межволоконных пространствах именуется основным (межфибриллярным) веществом. Остов основного вещества составляют тонкие нити протеогликановой природы с узловыми утолщениями и гранулами, образующими сетчатую структуру, хорошо выявляемую с помощью рутениевого красного. В петлях этой сети располагается также реагирующее с рутениевым красным так называемое аморфное вещество протеогликановой природы, обладающее высокой гидрофильностью. Все компоненты основного вещества являются единой системой, формирующей многокомпонентную интегрирующую метаболическую среду соединительной ткани.
Эта среда находится в тесном структурном и функциональном взаимодействии с волокнистой конструкцией матрикса, контактирует с поверхностными слоями коллагеновых и эластических фибрилл и волокон, а также с мембранами клеток.
Н.П. Омельяненко, используя метод полимерных реплик в сочетании с данными электронно-микроскопических исследований, сформулировал представления об интерстициальных пространствах соединительной ткани как системы микроканалов. В настоящее время это отчетливо установлено для хрящевой и плотной волокнистой соединительной ткани. Подмечено соответствие хорошо выявляемых каналов со степенью организации матрикса в тканях, где матрикс организован по принципу фибриллярной и волокон-но-фибриллярной структуры; в хрящевой и плотной волокнистой ткани каналы выявляются наиболее четко.
По данным Н.П. Омельяненко, удельный объем интерстициального пространства ткани различен. Так, в плотной оформленной соединительной ткани (сухожилие) он составляет 0,46 см/г3, в то время как в рыхлой соединительной ткани (по старой терминологии «неоформленной») — 2,1 см/г3. Эти данные — еще одна черта в характеристике плотностных показателей соединительной ткани.
Организация путей внесосудистой циркуляции в рыхлой соединительной ткани обсуждается лишь в немногих работах. Собственный опыт изучения матрикса рыхлой соединительной ткани на примере СО позволяет предположить, что организация путей интерстициальной циркуляции в матриксе рыхлой соединительной ткани связана с распределением конечных звеньев микроциркуляции (артериолы, венулы, капилляры). Эти внесосудистые (паравазальные пространства), содержащие коллагеновые фибриллы и основное вещество, в непосредственном контакте с базальной мембраной сосудов являются внесосудистым транспортным путем микроциркуляции. Наши данные коррелируют с наблюдениями В.В. Куприянова и Л.A. Манукян, согласно которым паравазальные пространства «обеспечивают необходимый функциональный настрой микроциркуляции».
