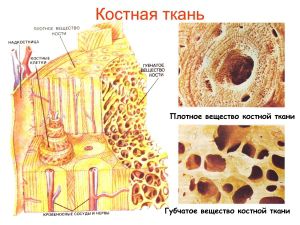
Клеточные элементы костных тканей
Согласно существующим представлениям, исходной клеточной формой для клеток как костных, так и хрящевых тканей является плюрипотентная мезенхимальная стволовая клетка (МСК).
Происхождение остеокластов связывают со стволовой гемопоэтической клеткой и происходящей от нее клеткой-предшественницей миелопоэза. Последняя определяет несколько линий клеточной дифференцировки и, в частности, моноцитарную линию.
Морфология основных типов клеток костных тканей
Остеогенные клетки-предшественники-преостеобласты. Остеогенные клетки-предшественники — производные мезенхимальных стволовых стромальных клеток (МСК) костного мозга. Они являются родоначальниками нескольких типов клеток-предшественников преостеобластов. Такие клетки уже коммитированы только для образования остеобластов. На процесс дальнейшей трансформации преостеобластов в остеобласты влияют многие факторы, среди которых: щелочная фосфатаза, костный морфогенетический белок (BMP) и др. Сохраняя способность к пролиферации, преостеобласты начинают синтезировать компоненты костного матрикса.
В организме взрослого человека преостеобласты находятся в костных каналах, во внутреннем слое надкостницы (периосте), а также среди клеток эндоста (эндостальные клетки). Полагают, что еще одним источником преостеобластов являются васкулярные перициты. Особенно большое количество преостеобластов выявляется в процессе развития костей скелета плода.
Остеобласты. Остеобласты — это клетки, формирующие, строящие костную ткань и поддерживающие ее в нормальном состоянии.
СМ дает представление об остеобластах как о крупных (20— 40 мкм) кубических или цилиндрических клетках с эксцентрично расположенным ядром, базофильной цитоплазмой, обнаруживающей при гистохимических реакциях большое количество РНК. Наиболее характерными структурами, выявляемые при ТЭМ, является ГЭС (каналы и цистерны с тонкофибриллярной субстанцией внутри), а также развитый комплекс Гольджи с вакуолями, заполненными мелкогранулярным аморфным веществом. В остеобластах также описаны крупные митохондрии, многочисленные везикулы вблизи клеточной мембраны, лизосомы (первичные и вторичные) и микрофиламенты.
Остеобласты — неоднородная популяция. Они отличаются по ультраструктуре, биосинтетической активности, локализации в развивающейся кости и по взаимоотношению с матриксом костной ткани. Используя эти показатели, Н.В. Родионова выделила четыре основных типа клеток, между которыми имеются переходные формы.
Остеобласты I типа — молодые клетки, по структуре близкие к преостеобластам. Гистохимические показатели свидетельствуют о высокой активности в них щелочной фосфатазы, а так же способности включать меченные Н3-уридин, Н3 — глицин, S35. Последнее указывает на интенсивную продукцию остеобластами коллагена и сульфатированных ГАГ.
Остеобласты II типа — зрелые и функционально наиболее активные клетки. От остеобластов I типа их отличают: большие размеры, хорошо развитая ГЭС и комплекса Гольджи, а также большое количество полиморфных митохондрий. Справедливо, по-видимому, заключение автора, что в процессах биосинтеза коллагена остеобласты II типа несут основную и наибольшую функциональную нагрузку.
Остеобласты III типа — гипертрофированные клетки, которые имеют большие размеры и содержат глыбки гетерохроматина в ядрах. Для таких клеток характерно, что расширенные каналы ГЭС составляют основной объем цитоплазмы. ГЭС у таких остеобластов представляет собой систему крупных цистерн, заполненных продуктом синтеза — коллагеном (отсюда одно из их названий - «депо коллагена»). Остеобласты III типа — последняя стадия развития остеобластического ряда клеток с исходом в деструкцию и гибель. Деструкции клеток предшествует выброс содержимого цистерн ГЭС в экстрацеллюлярное пространство. Полагают, что остеобласты III типа заняты не столько биосинтезом органического материала, сколько эвакуацией уже накопленного продукта за пределы клетки.
Отмечаются в отдельных участках кости, где идет угасание остеогенетических процессов, остеобласты IV типа (покоящиеся клетки). Для них характерна вытянутая форма, менее развитая ГЭС, обилие лизосом. Остеобласты этого типа располагаются в непосредственной близости от фронта кальцификации. Гистохимические показатели также свидетельствуют о более низком уровне секреторных процессов в остеобластах IV типа по сравнению с остеобластами I, II, III типов.
Остеоциты. Остеоциты — это высокодифференцированные клетки — основной тип клеток костной ткани. Структура ГЭС и рибосом указывает на функциональную активность клеток.
Главная роль остеоцитов состоит в обеспечении нормального функционирования костной ткани.
Между плазматической мембраной остеоцита и стенкой лакуны имеется пространство, называемое периостеоцитарным. Это пространство заполнено интерстициальной жидкостью. Общая площадь периостеоцитарных пространств у человека оценивается от 1000 до 50 000 кв. м, а общий объем интерстициальной жидкости составляет 1—1,5 л.
Остеокласты. Остеокласты — очень крупные подвижные многоядерные клетки размером до 20-100 мкм.
Наличие на мембранах этих клеток специфических макрофагальных рецепторов указывает на происхождение их от клеток макрофагальной линии дифференцировки. Образуются остеокласты при слиянии нескольких клеток моноцитарного ряда. Полагают, что при образовании остеокластов количество ядер у них увеличивается, в том числе за счет малодифференцированных одноядерных клеток того же генеза. Механизм, в результате которого происходит образование гигантского многоядерного остеокласта, остается пока неизвестным.
При увеличении числа и/или активности остеокластов под влиянием разнообразных факторов возникает ряд заболеваний, обусловленных усилением общей или местной резорбции костной ткани. Среди этих заболеваний наиболее часто встречается остеопороз.
Некоторые биохимические параметры костных клеток
Остеобласты. Остеобласт называют усовершенствованным, или усложненным, фибробластом. «Усложнение» отчетливо выявляется на молекулярном уровне. При сопоставлении (с помощью микронаборов комплементарной ДНК) экспрессии генов культивируемыми остеобластами и фибробластами человека установлено, что из 7,5 тыс. исследованных генов 95% экспрессируются с примерно одинаковой интенсивностью, однако для 5 % генов выявлены различия. У остеобластов выявлена значительно более интенсивная, чем у фибробластов, экспрессия 15 белков экстрацеллюлярного матрикса; только один белок из этой группы более активно экспрессировался фибробластами. Остеобласты отличаются также более высокой активностью генов, кодирующих белки цитоскелета, которые необходимы для упаковки и транспорта секретируемых макромолекул матрикса, а также белков, принимающих участие в апоптозе (запрограммированной гибели клеток).
Самым существенным генетическим регулятором дифференциации остеобластов является ген CBFal, кодирующий специфический для остеобластов фактор транскрипции Cbfal (другое название — Runx2). Cbfal необходим и зрелым остеобластам для поддержания их фенотипа.
Известен еще один ген, необходимый для последующей нормальной биосинтетической деятельности остеобластов — это ген LRP5. Нулевая мутация этого гена вызывает у мышей уменьшение костной массы вследствие угнетения пролиферации и активности остеобластов; этот эффект проявляется независимо от экспрессии Cbfal. Кроме того, в регуляции биосинтетической активности зрелого остеобласта участвуют, в частности, ген c-Src и фактор транскрипции Mitf.
Основные функции остеобласта можно, в самой обшей формулировке, определить как секреторные: дифференцированный остеобласт, утратив способность к митотическому делению, сосредоточивается на синтезе и секреции макромолекулярных компонентов экстрацеллюлярного матрикса костной ткани. Особенности биохимического фенотипа остеобласта заключаются в экспрессии специфических макромолекул. Перечень указанных макромолекулярных компонентов включает главный коллаген костной ткани — большой фибриллярный коллаген I типа, который в минерализованных тканях отличается некоторыми структурными особенностями, очень важными в функциональном отношении. В этот перечень входят неколлагеновые белки (гликопротеины) остеокальцин, остеонектин, остеопонтин, матричный Gla-белок, костный сиалогликопротеин, специфические цитокины и факторы роста и связанный с мембраной остеобласта фермент щелочная фосфатаза. Все эти компоненты в совокупности рассматриваются как маркеры фенотипа остеобласта.
Формирование данного фенотипа (или дифференциация остеобласта) — процесс, требующий определенного времени. Экспрессия отдельных маркеров начинается до завершения остеобластической дифференциации клеток. Остеокальцин является маркером, указывающим на завершение процесса остеобластической дифференциации клеток, когда происходит окончательное превращение остеобласта в остеоцит.
На более ранней стадии дифференциации остеобласта, когда экспрессия специфического для этой клетки фактора транскрипции Cbfal уже отчетливо выражена, а реакция на остеокальцин еще отрицательна, специфическим маркером остеобласта является секреторный белок остеокрин. Этот небольшой белок мол. м. 11,4 кДа обнаруживается исключительно в костной ткани, где его экспрессия достигает максимума вскоре после рождения, а затем постепенно снижается с возрастом. У культивируемых остеобластов экспрессия остеокрина совпадает по времени с интенсивным формированием экстрацеллюлярного матрикса.
Главная функция остеобласта — продуцирование и секреция органического экстрацеллюлярного матрикса костной ткани. Кроме того, остеобласт, по всей вероятности, также вовлечен в процесс минерализации и регулирует построение супрамолекулярной архитектоники матрикса, так что в определении остеобласта как костеобразующей клетки, или «архитектора скелета», нет преувеличения. Остеобласты, и именно они, создают костную ткань.
С экстрацеллюлярным матриксом остеобласт взаимодействует при помощи трансмембранных гликопротеинов — интегринов. Набор интегринов, экспрессируемых остеобластом, своеобразен. В регуляции экспрессии генов имеет значение влияние матрикса на остеобласт.
Во взаимодействии остеобластов с матриксом участвует также расположенный на цитоплазматической мембране (но лишенный в отличие от интегринов трансмембранного домена) специфический для остеобластов белок — специфический фактор остеобластов-2 (OSF-2), или периостин. Функция этого белка, состоящего из 811 аминокислотных остатков, рассматривается как адгезивная.
Остеоциты. Остеоциты — это завершившие цикл своего развития остеобласты, замурованные в толще минерализованного костного матрикса, не являются совершенно пассивными в метаболическом отношении. Они имеют рецепторы к гормонам (паратиреоидный гормон, андрогенные и эстрогенные гормоны) и, следовательно, способны реагировать на гормональные импульсы. Остеоциты, как и остеобласты (и даже более активно), экспрессируют белок (фосфогликопротеин) экстрацеллюлярного матрикса, известный под названием остеобластического/остеоцитарного фактора 45 (OF 45) или МЕРЕ. Возможно, что этот фактор тождественен другому фактору — склеростину, кодируемому геном SOST, активность которого высока у остеоцитов; его роль, очевидно, состоит в ограничении активности остеобластов и роста костей.
Особенностью остеоцитов является наличие отростков (в среднем каждая клетка имеет около 60 отростков), соединяющих клетки между собой через сеть канальцев, пронизывающих минерализованный матрикс. В составе структурных компонентов этих отростков содержатся специализированные белки межклеточных связей — коннексины. Таким образом, остеоциты не являются изолированными клетками, а организованы в сеть остеоцитов, сообщающуюся также с расположенными на поверхности кости остеобластами. Эту сеть рассматривают как информационную систему, в которой остеоцитам, способным воспринимать механические импульсы, принадлежит сенсорная роль. Механическая деформация кости при нагрузке вызывает деформацию и изменения конформации сенсорных белковых рецепторов клеточной мембраны остеоцитов. Предполагают также, что при этом усиливается поступление ионов кальция в клетки. Эти изменения на уровне трансмембранных рецепторов влияют на связанные с рецепторами белки, что в свою очередь меняет конформацию белков цитоскелета, в том числе актинина, и далее — белков нуклеоскелета остеоцитов. Так осуществляется передача механических импульсов к генетическому аппарату остеоцитов. Эту цепь сигналов называют механотрансдукцией.
На увеличение механической нагрузки остеоциты реагируют определенными функционально-биохимическими проявлениями. Они выполняют не только сенсорную, но и эффекторную функцию. Механическое воздействие на кость конвертируется в серию биохимических реакций. Установлены некоторые гены, экспрессия которых усиливается при таком воздействии. Эти гены названы генами, чувствительными к механическим нагрузкам. При механической нагрузке на кость отмечается усиленная экспрессия остеоцитами одного из гликопротеинов экстрацеллюлярного матрикса — тенасцина С. Таким образом стимулируется ремоделирование костной ткани, обеспечивающее биомеханическую адаптацию структуры костей к падающим на них механическим нагрузкам. Таков в современном понимании механизм действия закона Вольфа о соответствии макроструктуры кости биомеханическим условиям ее функционирования.
Остеокласты. Что касается остеокластов, то для ихдифференциации из моноцитов крови необходимы, по меньшей мере, 2 фактора. Во-первых, это один из циркулирующих белковых факторов роста— фактор, стимулирующий образование колоний макрофагов (M-CSF). Во-вторых, это секретируемый фактор белковой природы, присутствующий на цитоплазматической мембране остеобластов, а также клеток стромы костного мозга и активированных Т-лимфоцитов. Исходящий от него сигнал стимулирует дифференциацию остеокластов и повышает их функциональную активность.
Далее процесс дифференциации остеокластов контролируется генами c-Fms и M-CSF, которые особенно активны на начальной стадии дифференциации. Позднее активно экспрессируются гены, кодирующие факторы транскрипции C-fos, PU-1, NF-кВ, RANK, Fra-1.
Местные факторы стимуляции активности остеокластов изучены недостаточно. На процесс образования остеокластов и их активность влияют также интерлейкины.
Функция остеокластов прямо противоположна функции остеобластов: они резорбируют костную ткань. Начиная резорбцию, остеокласт поляризуется; его мембрана, обращенная к поверхности кости, приобретает ворсинчатое строение. В мембране ворсинок увеличивается количество каналов для ионов хлора и повышается активность транспортирующей водородные ионы аденозинтрифосфатазы V типа. Эта мембрана образует замкнутое пространство у поверхности кости, в которое клетка выделяет ионы хлора, подкисляющие среду до рН 4,5. В такой среде растворяются кристаллы гидроксиапатита, и органический матрикс костной ткани, в частности коллагеновые белки, становится доступным для действия протеолитических ферментов; активизируется большой комплекс лизосомальных гидролаз остеокласта; важнейшей из этих гидролаз является катепсин К.
В осуществляемой остеокластами деструкции костной ткани принимает участие и фермент тартратрезистентная кислая фосфатаза (TRAP), член семейства лизосомальных кислых фосфатаз. TRAP попадает в сыворотку крови. Определение уровня активности ее в сыворотке используют в клинической практике для количественной оценки деструкции костей. Кислую фосфатазу используют также в качестве чувствительной метки для гистохимической идентификации остеокластов.
Продукты деструкции костной ткани поглощаются остеокластом путем эндоцитоза и транспортируются внутриклеточными везикулами (пузырьками) к противоположной (свободной) поверхности клетки. На этом пути освобождающиеся аминокислоты утилизируются для синтеза новых белковых макромолекул, но специфические для костного коллагена I типа фрагменты макромолекул, в которых локализованы образующиеся на посттрансляционной стадии фибриллогенеза поперечные связи, не могут быть утилизированы повторно. Они попадают в циркулирующую кровь и экскретируются с мочой. Их экскреция отражает интенсивность метаболизма костной ткани.
В регулировании функции остеокластов существенная роль принадлежит, помимо перечисленных выше, еще двум факторам — фосфорилированному сиалогликопротеину остеопонтину и другому гликопротеину — остеопротегерину. Остеопонтин синтезируется главным образом остеобластами и способствует прикреплению остеокластов к поверхности кости. Эксперименты с выключением гена остеопонтина у мышей показали, что дефицит остеопонтина вызывает изменения цитоскелета остеокласта и нарушения экспресии трансмембранных рецепторов, сопровождающиеся нарушениями подвижности клетки. Противоположно направленным влиянием на функцию остеокластов обладает остеопротегерин. Он действует в роли ложного рецептора для RANKL. Связывая RANKL, остеопротегерин блокирует остеокластогенез, что приводит к замедлению резорбции костей.
