Варикозная болезнь нижних конечностей: что это такое, лечение, классификация, диагностика, причины, хирургия
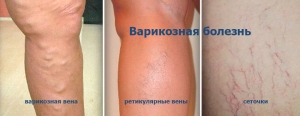
Периферическая венозная сеть нижних конечностей состоит из трех систем: поверхностной, глубокой и системы перфорантных вен.
В обеспечении венозного оттока также участвует клапанный аппарат вен, а также венозные синусы голени.
Поверхностная венозная система состоит из обширной сети сети вен, находящихся между кожей и глубокой фасцией. Эти вены большей частью взаимосвязаны и собирают венозную кровь в два магистральных поверхностных ствола — БПВ и МПВ. Их роль в формировании венозного оттока невелика — в целом система обеспечивает не более 10% возврата крови из нижних конечностей.
Говоря о БПВ. следует учитывать ее некоторые анатомические особенности, очень важные в выборе хирургической тактики. В отличие от МПВ большая сафена всегда впадает в бедренную приблизительно в одном и том же месте, но вариантов формирования соустья великое множество, и по результатам дуплексного ангиосканирования от термической облитерации следует отказаться в пользу оперативного вмешательства. Если БПВ находится на всем протяжении в фасциальном футляре (так называемый I тип) это идеальный вариант для тумесцентной анестезии и ее эндовенозной облитерации. Если сброс из БПВ осуществляется в приток на уровне верхней или средней трети бедра (h тип), то облитерация такого притока может привести к длительной пигментации. Кроме того, на голени она располагается в непосредственной близости от n. saphenus, и его повреждение может привести к длительным парестезиям или болевому синдрому. Это также необходимо учитывать при проведении эндовенозных вмешательств и минифлебэктомии. Наконец, у многих пациентов основной ствол удвоен и даже утроен (передние и задние добавочные вены), оставление которых приводит к быстрому рецидиву.
МПВ. Располагаясь латеральнее ахиллова сухожилия, она постепенно смещается к средней линии и на границе средней и верхней трети голени прободает глубокую фасцию голени. Характерной особенностью МПВ является ее непостоянство — у каждого третьего пациента МПВ может закончиться в БПВ, слиться с мышечными венами бедра, ягодичного сплетения, и даже иметь 2—3 места слияния с бедренной веной. В верхней трети голени МПВ образует многочисленные анастомозы с БПВ, которые могут варикозно изменяться при клапанной недостаточности ствола БПВ и даже вызвать вторичную дилатацию МПВ с вертикальным рефлюксом. Мы неоднократно убеждались, что после разобщения этих патологических притоков диаметр и функция МПВ полностью восстанавливались. Очень плотная фасция, в которой находится МПВ, всегда была и остается очень привлекательной с точки зрения хорошей компрессии после пенной склеротерапии. Во всяком случае, мы не обнаружили реканализации в МПВ после стволовой Foam-form склеротерапии ни в одном случае.
Перфорантные вены — это многочисленные мелкие тонкостенные сосуды от долей миллиметра до 2—3 мм в диаметре. Перфоранты также имеют однонаправленные клапаны. Проникая через отверстия в глубокой фасции, они могут напрямую вливаться в глубокие вены бедра или голени (прямые перфоранты) или опосредованно соединяться с ними через мышечные вены (непрямые перфоранты). При общем количестве 100-150 на одну ногу некоторые из них отличаются завидным постоянством и до последнего замени даже имели красивые собственные названия. В современно номенклатуре все перфорантные вены делятся на шесть групп по анатомическому признаку — перфораторы стопы, окололодыжечные, голени, коленного сустава, бедра и ягодичные перфоранты. По поводу перевязки перфорантных зен в среде флебологов до сих пор существуют полярные мнения — от необходимости перевязки всех расширенных перфорантов до полного их игнорирования как источника рефлюкса.
Глубокая венозная система собирает всю венозную кровь на пути к сердцу и начинается с трех пар глубоких вен голени: передние большеберцовые (берут начало с тыла стопы), задние большеберцовые (начинаются с медиальной части стопы) и малоберцовые вены (идут по латеральной части стопы). Все три пары вен (а также венозные синусы мышц голени), сливаясь на несколько сантиметров ниже головки малоберцовой кости, дают начало подколенной вене (v. poplitea). Это достаточно короткий ствол, располагающийся позади коленного сустава, является единственной магистралью в этом сегменте, и нарушение его проходимости всегда ведет к выраженной клинической манифестации с развитием отека. Смещаясь переднемедиально, подколенная вена проникает в приводящий канал и с этого момента называется бедренной веной, или поверхностной бедренной веной, которая после слияния с глубокой веной бедра в верхней его трети становится общей бедренной веной. В целом по глубокой венозной системе проходит до 90% крови, направляющейся к правому предсердию.
Клапанный аппарат в венозных сосудах имеет важнейшее значение для венозного оттока из нижних конечностей. Они помогают преодолеть силу гравитации, так как обеспечивают однонаправленный ток крови. Как правило они представлены двумя створками и обеспечивают центростремительное движение крови от лодыжки к сердцу . Количество их варьирует в зависимости от нагрузки — самое большое их число находится в глубоких венах голени и убывает в проксимальном направлении. В перфорантных венах также определятся по 2—3 клапана, за исключением перфорантных вен стопы, что нужно обязательно иметь в виду при склеротерапии этой области. Нарушение функции клапанного аппарата (первичное или вследствие перенесенного воспаления) является важнейшим звеном в патогенетической цепи развития ХЗВ.
Причины варикозной болезни нижних конечностей
За последнее столетие было выдвинуто множество теорий, объясняющих происхождение варикозной болезни, и, к сожалению, мы получили больше вопросов, чем ответов. Все версии сводятся к первичности поражения либо клапанного аппарата, либо венозной стенки, либо к гемодинамическим нарушениям кровотока с последующим запуском каскада реакций, приводящих к развитию варикозного синдрома. Некоторые исследователи считали первопричиной поражение нервного аппарата вен, другие отдавали пальму первенства врожденной слабости соединительной ткани организма. Ряд авторов полагал, что слабые участки вен разрушаются под влиянием гидравлических толчков крови, очень многие ученые и сейчас придерживаются теории наследственной предрасположенности. Группа исследователей под руководством академика B.C. Савельева выдвинула гемодинамическую теорию, согласно которой наследственно обусловленные изменения глубоких вен приводят к динамической гипертензии с последующим переходом на поверхностную венозную систему.
В последние годы с развитием технологий исследователи перешли на молекулярный и клеточный уровень, и уже сделаны громадные успехи в изучении взаимодействия «кровь—венозная стенка». Эндотелий фактически рассматривается как эндокринный орган, выделяющий множество биологически активных веществ. Определена роль гипоксии, (трения крови и венозную стенку), повышения гидростатического давления, лейкоцитарной агрессии в запуске каскада патологических реакций, приводящих к трансформации венозной стенки. Вероятно, полная разгадка величайшей тайны, связанной с прямо-хождением человека, будет сделана генетиками, молекулярными биологами, и прерывать патологическую цепочку будут не хирурги, а лекарственные препараты на ранних стадиях.
Многообразие мнений и исследований позволяют утверждать наверняка только одно — варикозная болезнь является многофакторным заболеванием. Мы обследовали детей наших пациентов в возрасте 10—15 лет, их родственников и при этом получили интересные данные. У 10% детей клапанный аппарат в одной или двух больших сафенах отсутствовал вовсе. Вероятно, что первые клинические проявления варикозной болезни у них появятся в старших классах школы или на первых курсах института. Еще у 10% детей диаметр основных стволов был относительно увеличен, но клапанный аппарат функционировал нормально. Не исключено, что первые признаки болезни у них появятся в более позднем возрасте, может быть, после включения «пусковых» моментов (беременность, тяжелые физические нагрузки, прием гормональных препаратов и т.д.). Совершенно ясно, что отрицать генетическую детерминированность (в той или иной степени) в качестве «матрицы варикоза» бессмысленно. В то же время у нас под наблюдением находится целый список пациенток в возрасте 40—45 лет с несостоятельностью соустья и ствола БПВ до голени без всяких клинических проявлений и нормальным диаметром БПВ. Многие из них рожали и занимались спортом, но развития болезни не произошло. Нам кажется, что иногда «генетической предрасположенности» мало и нужны какие-то триггеры, катализаторы, запускающие дальнейший процесс. В пользу этого также свидетельствуют находки в виде сегментарной несостоятельности БПВ в средней и нижней третях бедра при отсутствии несостоятельных притоков и перфорантных вен, здоровом терминальном клапане. Во всяком случае, так же как и много лет назад, мы вынуждены бороться с последствиями заболевания и надеяться на новые открытия в патогенезе ХЗВ.
Механизм венозного возврата
Венозная система нижних конечностей выполняет две функции: служит накопителем излишней (балластной) крови и является путем возврата крови от периферии к сердцу. По магистральным подкожным стволам кровь попадает в глубокую венозную систему (также и по перфорантам) и далее, преодолевая силу гравитации и меняющееся торакоабдоминальное давление, попадает в правое предсердие. Факторами, обеспечивающими «противодействие» силе тяжести, принято считать:
- пропульсивную деятельность сердца;
- передаточную пульсацию артерий, переходящую на сопутствующие вены;
- мышечную и мышечно-венозную помпу;
- присасывающее действие легких и диафрагмы:
- сдавление подошвенной венозной сети при ходьбе:
Каждый по отдельности из этих факторов кажется незначительным, но их тончайшее взаимодействие создает кажущуюся нереальной картину венозного возврата, особенно у неподвижно лежащего челок
Главная роль в этом процессе, конечно, принадлежит мышечно-венозной помпе, или «мышечному насосу». При сокращении мышц голени и сдавлении венозных синусов происходит мощный выброс венозной крови в глубокие вены, так как клапанный аппарат не дает возможности для движения крови в дистальном направлении. В фазе расслабления происходит быстрое заполнение синусов из нижележащих отделов за счет градиента давления и опять же клапанного аппарата, созданного для однонаправленного движения. В связи с похожими механизмами мышечно-венозную помпу даже называют «периферическое сердце». Понятно, что при несостоятельности клапанов, нарушении проходимости вен «насос» перестает работать на полную мощность, объем венозной крови в сосудах нижних конечностей начнет увеличиваться и постепенно запустится каскад патологических изменений в венозной стенке.
Вертикальный и горизонтальный рефлюкс
Сброс крови по несостоятельным стволам большой и малой подкожным венам называется вертикальным рефлюксом. Иногда встречается источник рефлюкса из малого таза, который также можно считать разновидностью вертикального рефлюкса. Часто встречается несостоятельность клапанов БПВ, но ретроградный ток иногда происходит не в сафену, а в приток на бедре, что тоже считается вариантом вертикального рефлюкса. Недостаточность клапанов МПВ также явление нередкое, как правило, рефлюкс ограничивается верхней третью голени. Более часто мы наблюдаем несостоятельность перфорантных вен, иногда как изолированную проблему, но чаше вследствие массивного сброса крови через ствол или приток БПВ. Эти перфоранты чаше определяются в нижней трети голени по медиальной поверхности. Такой рефлюкс называется горизонтальным. Нам удалось лечить пациентку через 25 лет после классической флебэктомии с перевязкой всех притоков и перфорантных вен. При обследовании причиной рецидива стал изолированный перфорант в средней трети бедра (Гюнтера) и ягодичный перфорант.
Еще реже встречается несостоятельность клапанов глубоких вен. Чаще всего встречается рефлюкс по подколенно-бедренному сегменту, и может быть как следствием перенесенного тромбоза, так и иметь в своей природе первичное недоразвитие клапанов.
Диагностика варикозной болезни
В условиях постоянно развивающихся инструментальных методов диагностики такие простые вещи, как сбор анамнеза и жалоб пациента, все чаще отходят на второй план. Общение с пациентом сводится к формуле «раздевайтесь — сейчас сделаем УЗИ — ваше лечение будет состоять из...». Это в корне неверно, и сбор анамнеза и жалоб пациента дает до 90% информации о заболевании. В беседе с пациентом нужно выяснить характер болевых ощущений, около половины которых относятся к заболеваниям опорно-двигательного аппарата. Ночные и утренние боли не характерны для варикозной болезни. Особенно важно учитывать, что венозная боль не коррелирует с тяжестью заболевания, а является следствием нарушения микроциркуляции и последующего воспаления. Типичные «венозные» жалобы проявляются в виде тяжести в икроножных мышцах, особенно к вечеру, утомляемости ног, которая проходит после придания конечности возвышенного положения. Каждый пятый пациент отмечает периодические ночные судороги, иногда появляется зуд и чувство жжения в нижней трети голени.
Сбор анамнеза дает представление о том, кто из родственников страдает (или страдал) варикозным расширением вен, род деятельности, прием гормональных препаратов, количество беременностей или занятия спортом (производящие факторы варикоза). Необходимо выяснить причины смерти ближайших родственников для исключения наследственной тромбофилии. Выявление сопутствующих заболеваний вообще в корне может изменить тактику лечения, или потребует длительной подготовке к нему, или выявить, например, сердечную природу отеков.
Осмотр пациента проводится в вертикальном положении с использованием специальной подставки. Для осмотра БПВ пациент располагается лицом к врачу, с ротированной наружу конечностью. При этом оценивается наличие или отсутствие отека лодыжки, варикозных вен, липодерматосклероза, ретикулярных вен. Телеангиэктазии на бедре (чаще по латеральной поверхности), скорее всего, являются косметическим дефектом (следствием прожитых лет), но иногда вызывают чувство жжения и при УЗИ определяются как окончание передней добавочной вены. Особое внимание следует уделить медиальной и латеральной лодыжкам — появление ретикулярных вен и телеангиэктазий в этой области, скорее всего, свидетельствуют о серьезном поражении венозной системы. Пальпация может выявить не видимое глазу подкожное расширение вен, участки с повышенной температурой. Пальпируемые в медиальной части бедра расширенные вены чаще всего принимают за БПВ, хотя в большинстве случаев они являются ее притоками. Иногда видимые на голени узлы могут оказаться мышечными грыжами. При ангиосканировании в их проекции не определяются сосудистые образования. При отсутствии ультразвукового аппарата их можно пунктировать для контроля, и если кровь в игле не получена, то сомнений не остается. Еще проще попросить пациента выполнить тыльное сгибание стопы, при этом выпячивания исчезают. Наличие плотных образований в проекции вен может служить симптомом перенесенного ранее тромбофлебита подкожных вен. Для исключения артериальной патологии необходимо ощупать стопу и определить пульсацию в ее тыльных артериях. Узлы в нижней трети голени по медиальной поверхности, скорее всего, окажутся несостоятельными перфорантами Кокетта.
Для осмотра зоны МПВ необходимо развернуть пациента спиной к вам. В первую очередь проводится пальпация в области подколенной ямки, где расширенная МПВ определяется как упругоэластичная трубчатая структура и диагноз уже почти не вызывает сомнений. Наличие варикозных вен в верхней трети голени говорит, скорее всего, о недостаточности клапанов ствола БПВ с последующим сбросом в коммуникантные голени. Иногда причиной варикозных вен в этой области оказываете перфорант, располагающийся чуть выше подколенной ямки и латеральнее МПВ. При этом малая сафена может оказаться абсолютно интактна — незначительного диаметра и с полностью состоятельными клапанами. Варикозные вены в средней и нижней трети голени по задней поверхности чаще всего указывают на несостоятельность клапанов МПВ, хотя анастомозы с БПВ могут сыть и в этих местах.
Дуплексное ангиосканирование, это метод совершил «революцию» в нашем понимании сложности и вариабельности строения поверхностной венозной системы. Трудно представить себе флеболога, не владеющего основами ультразвуковой диагностики. Сейчас дуплексное ангиосканиирование применяется для оценки состояния глубокой и поверхностной системы вен, выявлении перфорантных сбросов, разметки подлежащих лечению сосудов непосредственно перед операцией. В течение всего послеоперационного периода ультразвук помогает оценить эффективность лечения, вовремя обнаружить тромботические осложнения и провести адекватную терапию. Учитывая вариабельность расположения притоков БПВ, можно детально представить предстоящую кроссэктомию со всеми ее особенностями, начиная от уровня разреза и заканчивая топографической анатомией притоков. Эндоваскулярные вмешательства вообще невыполнимы без ангиосканирования. Ультразкуковой аппарат используют для пункции вены, контроля проведения световода или электрода, позиционировании их в области соустий и проведения тумесцентной анестезии. Также метод позволяет обнаружить препятствия при проведении катетеров, оценить характер препятствия и возможность обойти его.
Дуплексное ангиосканирование проводится в реальном времени и подразумевает использование от одного до трех режимов: В-режим, цветное картирование и импульсно-волновой допплер. Основным является В-режим, который дает изображение сосудистых структур и окружающих тканей (серая шкала), на который часто накладывается цветное допплеровское изображение, что позволяет одновременно оценить не только анатомические особенности, но и получить информацию о кровотоке в просвете обследуемого сосуда. Изменение кровотока отображается разными цветами, что позволяет в режиме реального времени выявить патологический рефлюкс. При недостатке информации исследователи часто используют звуковой допплер, который дает информацию одновременно обо всех сосудах, находящихся в зоне датчика.
Визуализация вен требует высокого разрешения, поэтому для ультразвукового сканирования используют линейные датчики с частотой 5—13 МГц. Для скрининговых исследований вполне достаточно использование портативных аппаратов, однако при некоторых гемодинамических нарушениях скорость кровотока может быть очень низкой — ниже, чем пороговая величина аппарата. В сомнительных случаях обязательно нужен прибор с высокочастотными излучателями для определения низкоскоростных потоков крови. Иногда мы для этого используем серую шкалу, где при внимательном рассмотрении можно визуализировать движение форменных элементов.
Раньше исследование проводили в горизонтальном положении, в настоящее время стандартом является вертикальное положение пациента (это повышает точность исследования) на специальной подставке. Ее использование делает процедуру более удобной для врача. При возникновении головокружения (иногда бывает после неоднократных проб Вальсальвы) дистальную часть конечности можно осматривать и в положении сидя. Мы начинаем осмотр пациентов в горизонтальном положении с ротированной кнаружи конечностью. Вначале осматривается сафено-феморальное соустье, измеряется его диаметр, анатомические особенности, количество притоков, наличие дополнительных стволов. Далее БПВ осматривается на всем протяжении, выявляется наличие рефлюксов, измеряется диаметр, отношение к фасции (достаточно часто сброс крови продолжается в надфасциальный приток в верхней или средней трети бедра, который ошибочно принимают за БПВ), выявляются все патологические и нормальные перфорантные вены (важно при проведении склеротерапии). Иногда можно визуализировать спайки в просвете вены после неудачной склеротерапии. что зачастую меняет тактику лечения. Одновременно можно осмотреть и проксимальный участок бедренной вены, особенно у худых пациентов. После этого пациента укладывают на живот и проводят обследование МП В аналогичным образом. Особенно пристальное внимание уделяется месту впадения МП В в глубокую сеть, так как анатомия этой области отличается чрезвычайной вариабельностью. Также исследуют глубокие вены голени, подколенную вену. Очень важно локализовать место впадения суральных вен, так как иногда они могут образовать общее соустье с МПВ и их блокировка при лечении может вызвать нарушение оттока со всеми вытекающими последствиями. После этого пациент переводится в вертикальное положение, и осматриваются зоны, вызвавшие сомнения. Это бывает достаточно часто при несоответствии жалоб и клинической картины заболевания с полученными в горизонтальном положении данными ангиосканирования. Поскольку пациенту сложно в вертикальном положении выполнить прием Вальсальвы, существуют два других способа определить рефлюкс: компрессия пальцами выше датчика с последующим устранением сдавливания; компрессия ниже датчика с последующим устранением сдавливания. Необходимо отметить, что именно в этот момент врачу необходимо сопоставить клиническую картину заболевания с данными ультразвукового ангиосканирования и принять единственно правильное решение — как лечить пациента.
Исследование глубоких вен чаще проводят лежа на спине, и, кроме линейных датчиков, часто используют конвексные с частотой 3,5—5 МГц. Это необходимо при обследовании вен малого таза и забрюшинного пространства, у тучных пациентов и при наличии выраженного отека. Для определения тромбоза также используют В-режим, цветовую и спектральную допплерографию.
Особенно эффективна компрессионная проба для исключения тромбоза глубоких вен. Если в норме вены полностью спадаются при надавливании датчиком, то при обструкции достичь этого не удается. В просвете тромбированной вены определяются гиперэхогенные включения. Затем датчик устанавливается вдоль вены, и проводится цветное допплеровское картирование для оценки кровотока.
Ультразвуковая допплерография как самостоятельный метод применяется в настоящее время редко, в связи с улучшением технической оснащенности клиник. Может применяться в тех случаях, когда имеются начальные формы варикоза, например, перед склеротерапией ретикулярных вен для исключения рефлюкса или пациентам, которым не планируется хирургическое лечение. Заключается метод в появлении звуковых сигналов при проведении функциональных проб — отсутствие звукового сигнала при проведении компрессионных проб свидетельствует об окклюзии сосуда, а его появление в период расслабления мышц подтверждает рефлюкс.
Плетизмография — дополнительный - метод обследования, предназначенный для оценки функции венозное системы. Если вышеописанные методы дают представление о локализации и характере процесса, плетизмография (фотоплетизмография, воздушная, окклюзионная) дает информацию о степени нарушения венозного оттока. Чаше всего используется в процессе лечения ХВН для оценки его успешности.
В некоторых случаях при неясных ситуациях требуются дополнительные методы диагностики — флебография, КТ, МРТ и др. Эти методы используют в диагностике окклюзий и стенозов крупных вен малого таза, забрюшинного пространства и грудной клетки, а также при планировании реконструктивных операций на сосудах.
Лечение варикозной болезни нижних конечностей
Хирургия
Целью хирургического лечения является полное устранение вертикальных и горизонтальных рефлюксов, удаление патологической венозной емкости (трансформированных притоков и стволов), ликвидация косметических дефектов (ретикулярных вен и телеангиэктазий), вызванных основным заболеванием. Для достижения этих целей применяют следующие хирургические методы:
- комбинированная флебэктомия (кроссэктомия с удалением ствола БПВ или МПВ);
- эндовенозная лазерная коагуляция (ЭВЛК) магистральных стволов и/или перфорантов;
- радиочастотная абляция магистральных вен и/или перфорантов;
- химическая облитерация магистральных вен (эхосклерооблитерация);
- минифлебэктомия;
- трансиллюминационная флебэктомия (Trivex);
- склеротерапия;
- лазерная коагуляция.
Всегда следует иметь в виду, что варикозная болезнь — хроническое и прогрессирующее заболевание и ни один из этих методов не является универсальным. Каждый из них может сопровождаться определенным процентом рецидивов и со временем может развиться несостоятельность в других венах. Умение использовать сочетание этих методов в каждом конкретном случае и характеризует класс врача. Первые четыре метода предназначены для операций на магистральных венах.
Вмешательства с устранением вертикального рефлюкса
Комбинированная флебэктомия — это классическая операция, которая включает операцию Троянова—Тренделенбурга, удаление ствола магистральной вены до нижней границы рефлюкса (по Бэбкокку), перевязку всех несостоятельных перфорантов и удаление трансформированных притоков. Если первая часть операции на протяжении десятков лет не претерпела изменений, то в отношении ствола и притоков появились новые возможности — эндовенозные методы облитерации, криостриппинг, эндоскопическая диссекция перфорантных вен, склеротерапия притоков. Флебэктомия, несомненно, сохранила свою актуальность и в наши дни, несмотря на самую высокую ее травматичность. Связано это, как ни странно, не столько с отсутствием необходимого оборудования в стационарах, а с материальными причинами — инновационные методы достаточно дороги, страховые компании также неохотно оплачивают дорогостоящие методики. По данным мирового анализа, эта ситуация характерна не только для России — где-то страховые компании компенсируют только склеротерапию, в других странах — эндовенозное лечение, в третьих — выплачивают определенную сумму независимо от выбора пациента. В некоторых случаях без классической операции не обойтись из-за слишком большого диаметра сафено-феморального соустья, веретенообразного расширения БПВ в области соустья или наличия спаечного процесса в БПВ после неудачной эхосклерооблитерации.
Операция Троянова-Тренделенбурга — сейчас носит название кроссэктомия (удаление перекрестка). Этот термин более удачный, так как по классической методике авторов пересечение сафены проводилось ниже места впадения БПВ в бедренную с оставлением длинной культи и притоков. До начала 1990-х годов использовали косопродольный разрез по Червякову, но в дальнейшем от него отказались из-за неудовлетворительных косметических результатов и риска повреждения лимфоузлов с последующей лимфореей. В современной хирургии используют надпаховый, чрезпаховый и подпаховый разрезы. В идеальном варианте правильный доступ определяется на операционном столе при помощи ультразвукового датчика, или, в крайнем случае, накануне хирург должен присутствовать при УЗИ пациента, так как сафено-феморальное соустье более чем в 15% может находится выше или ниже паховой складки. Если такой возможности нет. то выстраивается на коже треугольник, одной стороной которого будет паховая складка, второй — бедренная артерия (определяется по пульсации). Биссектрисой этого угла и будет большая сафена, при этом сафено-феморальное соустье располагается дистальнее этого угла на 1—2 см. В выборе доступа главное место занимает дуплексное ангиосканирование, позволяющее хирургу точно определить количество и топографию притоков, расположение сафено-феморального соустья. Например, если обнаружены крупные притоки ниже соустья на 4—5 см. предпочтительнее подпаховый доступ для одновременной их перевязки, у молодых женщин с косметической целью лучше выполнить надпаховый доступ и т.д.
Стриппинг — вторая часть комбинированной флебэктомии, заключающаяся в удалении некомпетентного ствола БПВ или МПВ. Для этого используют металлические зонды различных модификаций со съемными оливами. Существуют антеградный и ретроградный способы стриппинга. Большая часть флебологов предпочитает ретроградную тракцию (сверху вниз), так как клапаны не мешают проведению зонда через ствол удаляемой вены. Исключение составляет криостриппинг, при котором зонд вводится в вену ретроградно, вена «примерзает» к зонду и удаляется без дистального разреза. В классическом варианте (операция Бэбкокка) проводится тотальный стриппинг от паха до лодыжки, но в современном мире стандарты радикально изменились и появился термин «короткий стриппинг», а для изатечения ствола используют инверсионный метод (PIN-стриппинг). При помощи тонких зондов вену инвагинируют, что достоверно уменьшает травматизацию окружающих тканей. В подавляющем большинстве случаев рефлюкс в БПВ заканчивается в верхней трети голени или на границе бедра и голени, в МПВ — на уровне верхней и средней трети голени.
Флебэктомия на голени может повредить n. saphenus со всеми вытекающими из этого последствиями. Можно дополнить короткий стриппинг интраоперадионной эхосклеротерапией дистальной сафены или оставить для второго этапа через 1—2 мес, когда стихнет операционная травма. При двухэтапном лечении мы очень часто обнаруживаем резкое уменьшение диаметров варикозных вен через 1—2 мес после парциального стриппинга на бедре. В случае выраженного липодерматосктероза, целлюлита в нижней трети голени мы рекомендуем только двухэтапное лечение, причем второй этап рекомендуем перенести на 2—3 мес. Если же вы решились на одномоментную эхосклеротерапию, то следует иметь в виду несостоятельные перфоранты на голени и вводить пену в строго ограниченных количествах под постоянным УЗИ-контролем во избежание контакта склерозанта с глубокими венами.
Эндовенозная лазерная облитерация (endovenous laser treatment) — способ лечения магистральных вен путем подачи тепловой энергии внутрь сосуда при помощи специальных световодов для доставки излучения к месту воздействия. Не прошло и ста лет, как предсказанная А. Эйнштейном возможность индуцирования электромагнитным полем излучения атомов превратилась в создание квантового генератора (не без помощи наших ученых Н. Басова и А. Прохорова). В 1960 г. американский физик Теодор Мейман сконструировал первый рубиновый лазер. В 1990-х годах появилось новое поколение компактных и недорогих лазеров на основе полупроводников и изучено их влияние на оптические свойства крови (поглощение гемоглобином и водой). В 1998 г. были опубликованы первые сообщения С. Bone о внутрисосудистом применении лазера при варикозной болезни. Механизм термического воздействия основывался на поглощении тепловой энергии гемоглобином и опосредованном воздействии «пузырьков пара» на эндотелий сосуда. Дальнейшее развитие эндовенозной лазерной облитерации пошло невероятно быстрыми темпами — за несколько лет появилось поколение «жидких» лазеров с другой длиной волны и воздействующих на воду в венозной стенке, торцевые световоды сменились на радиальные JACKET и DOUBLE RING. Изданы сотни статей о преимуществах и сравнительных результатах лечения различными типами лазеров, Несомненно одно — лазерные технологии прочно вошли в жизнь флеболога, доказали свою эффективность и безопасность. С какой длиной волны, плотностью потока энергии работать, определяется пока конкретным опытом отдельного конкретного специалиста, и не существует определенных стандартов в этом многообразии. Кто-то предпочитает использовать автоматические устройства для тракции световодов, другие считают мануальное извлечение удобным способом для различного воздействия на участки разных диаметров. Даже показания и противопоказания к применению ЭВЛК за последние несколько лет претерпели значительные изменения.
Показания к ЭВЛК аналогичны целям, которые ставит перед собой хирургическая операция — ликвидация патологических рефлюксов и удаление (облитерация) некомпетентных магистральных вен, а также несостоятельных перфорантных вен. Для лазерных аппаратов с длиной волны 810—1064 нм рекомендуется линейная плотность энергии 70—120 Дж на 1 см вены, т.е. при мощности 10-15 Вт скорость тракции световода должна составлять 1-2 мм/с.
Предпочтение отдается световодам с радиальной эмиссией излучения, хотя имеется ряд сравнительных исследований, при которых результаты применения торцевых и радиальных световодов сравнимы, так же как и «гемоглобиновых» и «водных» лазеров. Вероятно, это предмет для будущих дискуссий, но главным, конечно, является личный опыт врача, как и выбор, например, режима излучения.
Противопоказания к ЭВЛК и как они меняются, рассмотрим ретроспективно на одной из первых и лучших монографий по лазерной хирургии варикозной болезни 2010 г.
- Приустьевое расширение БПВ более 10 мм из-за большого количества неудовлетворительных результатов. Еще недавно с этой позицией соглашались безоговорочно все. В настоящее время в литературе накоплен богатый опыт удачного применения эндовенозной лазерной облитерации с диаметрами сафены ив 15 и в 20 мм, хотя достоверных отдаленных результатов еще не приведено, и мы не исключаем разочарований. Во всяком случае, если у таких пациентов выявится рецидив в культе (3—5 см), то это уже сейчас становится предметом дискуссии — как бороться с оставленной культей, с какой скоростью возникают рецидивы в притоках и насколько сложно с ними бороться.
- Значительное количество расширенных притоков. Имеется в виду, что травма, полученная в результате удаления большого количества расширенных притоков, будет настолько велика, что разница между эндовенозной лазерной облитерацией и стриппингом магистрального ствола уже будет незначительной. На сегодняшний день накоплен большой опыт щадящих манипуляций с притоками, например, их одномоментная склеротерапия. Учитывая ограничения по количеству вводимого склерозанта, можно воспользоваться их пенными формами, которые хорошо визуализируются под ультразвуковым контролем и позволяют облитерировать большее количество притоков. Часть их можно оставить для второго этапа и провести минифлебэктомию через 2—3 мес. Ряд авторов считают обязательным удаление варикозных коммуникантов на бедре одновременно со стриппингом из-за возможного их тромбофлебита, другие накопили достаточный опыт отсроченного удаления их на бедре. Возможно комбинировать минифлебэктомию со склеротерапией, особенно у пациентов с запущенными формами заболевания, при которых притоки трудно отделимы от кожи. В этих случаях мы с успехом применяем лигатурную варикосклерооблитерацию. Технически в современном варианте это выглядит следующим образом. Под контролем ультразвукового датчика мы накладывает на трансформированный приток 10—15 швов вокруг вены на расстоянии 10 см друг от друга, концы нитей не затягиваем. Место вкола должно совпадать с местом выкола, при этом стенка вены не должна быть повреждена иглой при манипуляции. После этого пунктируем вену катетером и приподнимаем конечность, чтобы освободить сосуд от крови и медленно под ультразвуковым контролем вводим приготовленную по Тессари пену, после чего нити затягиваем и завязываем. Такая манипуляция малоболезненна, позволяет облитерировать значительное количество трансформированных притоков и легко переносится пациентами.
- Анатомические трудности — извитой ствол или аневризматическое расширение его, удвоение ствола и т.д. Любые технические сложности проведения манипуляции должны быть проанализированы до операции, чтобы принять правильное решение. Современные эндовенозные проводники позволяют выполнить пункцию вены в двух, трех или даже четырех местах, причем это занимает не более 1 мин. При недостаточном опыте пункций можно воспользоваться крючками Мюллера, Эша или Рамеле. Венесекция в опытных руках под контролем ультразвука занимает также не более 2—3 мин, поэтому с накоплением опыта технические сложности перестают быть противопоказанием для ЭВЛК.
- Реканализация вены после стволовой склеротерапии. Действительно, после неудачной эхосклерооблитерации магистральной вены, а также после перенесенного ранее тромбоза в просвете вены часто можно наблюдать различное количество стриктур и спаек, что затрудняет проведение световода и создает угрозу отрыва какого-либо внутрипросветного образования с печальными последствиями. В большинстве случаев мы наблюдали эту картину до средней трети бедра. БПВ извлекалась под ультразвуковым контролем выше стриктур при помощи набора для минифлебэктомии и проводилась ЭВЛК ее проксимального участка, затем безопасно проводилась коагуляция дистального отрезка или эхосклеротерапия при невозможности заведения световода. При наличии внутрипросветных образований в верхних отделах сафены лечение всегда надо начинать с кросс эктомии.
- Наличие воспалительных заболеваний кожи и подкожной клетчатки в зоне вмешательства, как возможный источник инфекции, является скорее не противопоказанием к операции, а состоянием, требующим коррекции перед операцией, так же как и период острой гнойной экссудации трофической язвы, когда уже через несколько дней после начала лечения уже можно выполнить как минимум короткий стриппинг.
Таким образом, по мере приобретения опыта использования ЭВЛК, повышения уровня мастерства врачей противопоказаний к этому популярному методу лечения ХЗВ становится все меньше, хотя всегда надо опасаться преждевременной эйфории, как это не раз бывало в истории медицины.
К общим противопоказаниям проведения ЭВЛК относятся: установленная тромбофилия, невозможность адекватной компрессии (ожирение), хронические заболевания артерий нижних конечностей, тяжелые сопутствующие заболевания и невозможность ранней активизации больного после проведенной операции. Все эти противопоказания являются относительными и устанавливаются на усмотрение врача. Например, если ношение компрессионного трикотажа в течение семи дней не вызовет резкую ишемию конечности, то такое лечение возможно. Коррекция сопутствующих заболеваний также значительно расширяет возможности ЭВЛК. Пациентам с тромбофилией назначается особый протокол антикоагулянтной терапии.
Эндовенозная радиочастотная облитерация (VNUS Closure) — малоинвазивная методика, являющаяся альтернативой стриппингу, так же как и эндовенозная лазерная облитерация. Этот способ основан на точном приложении энергии радиочастотного излучения через специальный катетер в просвет вены, приводящей к ее окклюзии за счет коагуляции коллагена. При температуре 120° происходит термическое повреждение эндотелия и среднего слоя венозной стенки. В отличие от эндовенозной лазерной облитерации, когда проводится ручная тракция световода (за исключением автоматического экстрактора), электроды VNUS Closure FAST оснащены технологией посегментной абляции через нагревательный элемент 7 см длиной. При этом обеспечивается однородный нагрев вены на каждом участке и осуществляется постоянная обратная связь — на экране постоянно отображается мощность, подаваемая для достижения необходимой температуры, а также контроль самой температуры в режиме реального времени. Каждый катетер оснащен каналом, который рекомендуется перед процедурой промыть физраствором и закрыть заглушкой.
Каждый цикл длится 20 с, запуск воздействия осуществляется стерильной кнопкой на другом конце электрода самим хирургом и сопровождается звуковым сигналом. Врач, выполняющий процедуру, таким образом может выбирать количество необходимых циклов без помощников, одновременно наблюдая за показателями очень удобного интерфейса, которые легко читаются на расстоянии. Для установки электрода пункционным способом доступны специальные наборы (интродьюсер 7 F, катетер и проводник), сам электрод градуирован по всей длине для контроля его извлечения во время манипуляции. Электрод бывает двух видов — 60 и 100 см длиной.
Показания и противопоказания для проведения радиочастотной облитерации ничем не отличаются от приведенных выше для ЭВЛК, так как технические процедуры почти одинаковы в обоих случаях. Окончательный выбор остается за предпочтениями врача, опыта, наличием того или иного оборудования. Во всяком случае, стоимость расходных материалов для обеих манипуляций приблизительно одинакова.
Термальная абляция паром высокой температуры предложена французским исследователем Р. Миллере в 2008 г., в нашей стране пока широкого использования не получила. Основан метод на подаче пульсирующей струи пара в просвет вены.
Техника проведения термооблитерации
Вся процедура от начала и до конца проводится под эхоконтролем. Пациент укладывается в положение, при котором будет проводиться манипуляция. После этого бриллиантовым зеленым или специальным маркером размечают ход БПВ (или МПВ), границу рефлюкса и соустья. При этом важно отметить отхождение от ствола крупных притоков, чтобы не повредить их во время тумесцентной анестезии. Разметку можно проводить как до обработки ноги антисептиком, так и в стерильных условиях. Для выполнения процедуры бывает вполне достаточно одного хирурга и медицинской сестры, однако для удобства чаще всего операция выполняется двумя врачами — это ускоряет ход и время операции. В любом случае неподалеку должны находиться коллеги на случай непредвиденной экстренной кроссэктомии или кровотечения.
Под местной анестезией 1% лидокаином проводят пункцию вены по Сельдингеру, как правило, на уровне нижней границы рефлюкса под эхоконтролем в/в катетером, через который устанавливается проводник и интродьюсер. Пункционный метод введения световодов и электродов значительно ускоряет и упрощает манипуляцию. Если диаметр вены мал, то можно попросить пациента потужиться или опустить ножной конец стола на 30° для увеличения просвета сосуда. При неудачной пункции необходимо попробовать сделать это чуть выше после снятия спазма с вены, либо воспользоваться набором для минифлебэктомии и провести венесекцию через прокол-разрез. Для этого над местом извлечения магистрального сосуда после инфильтрационной анестезии кончиком остроконечного скальпеля или иглой 19 G делается миниразрез 3—4 мм длиной, через который вводится игла и под эхоконтролем выполняется гидропрепаровка вены между листками поверхностной фасции. Таким образом, вена свободно «плавает» между листками фасции и после вскрытия переднего листка фасции без натяжения элиминируется кнаружи. После пересечения между зажимами в проксимальный ее конец устанавливается световод (электрод), дистальный конец перевязывается. В опытных руках это занимает 2—3 мин и дает ряд немаловажных преимуществ. При несостоятельной дистальной части сафены можно одномоментно с термической облитерацией выполнить и склеротерапию нижележащих отделов. Чаще всего мы делаем про-кол-разрезы в верхней трети голени, где рефлюкс уходит в притоки и можно воспользоваться этим же местом для начала минифлебэктомии притоков. С экономической точки зрения возникает некоторая экономия средств, необходимых для закупки проводников и комплектующих к ним, особенно если количество операций исчисляется десятками в месяц.
Введение и позиционирование световода (электрода) также осуществляется под постоянным эхо-контролем. Описаны казуистические случаи неконтролируемого введения электрода в общую бедренную вену с фиксациеи последнего в ней. Ультразвуковой контроль-также помогает вовремя обнаружить паравазальное введение катетера, обойти сложные анатомические изгибы, фиксацию кончика катетера в притоке. Основным условием правильного проведения световода является его «плавность» — не должно быть никаких резких движений во избежание перфорации. При обнаружении препятствия проводится его изучение ультразвуковым датчиком, далее кожа и подкожная клетчатка берутся в складку и сдвигаются в ту или иную сторону, в зависимости от ультразвуковой анатомии участка до тех пор, пока движение катетера вновь не примет плавный ход без видимых усилий. Далее, используя попеременно продольное и поперечное положение датчика по отношению к световоду (электроду), устанавливают его кончик на 2—3 мм дистальнее последнего притока (как правило, это v. epigastrica superficialis), с целью профилактики тромбоза культи БПВ. Необходимость оставления притока сегодня также является предметом для дискуссий, и описаны случаи введения катетеров непосредственно в приток без оставления культи. При облитерации МПВ рабочая часть устанавливается стандартно — в 1 см от СПС.
Тумесцентная анестезия — разновидность местной анестезии, при которой разбавленный анестетик вводится в больших количествах в виде плотного инфильтрата вдоль вены, в случае радиочастотной абляции или ЭВЛК — между листками поверхностной фасции. Для приготовления такого раствора необходимо смешать 50 мл 1% лидокаина и 450 мл физиологического раствора, добавив туда для нейтрализации 5—10 мл 8,4% натрия гидрокарбоната. При непереносимости лидокаина успешно используются другие анестетики — бупивакаин (Маркаин), ропивакаин в соответствующих концентрациях. Без преувеличения можно сказать, что тумесцентная анестезия расширила наши возможности лечения пациентов в пожилом и старческом возрасте. Большой объем анестетика при его малой токсичности облегчает выполнение мини-флебэктомии, в случае с эндовазальной термооблитерации производит несколько эффектов. Водная подушка изолирует окружающие ткани от термического воздействия во время процедуры, дает надежный обезболивающий эффект. Катетер при этом плотно обжимается веной для более ровного воздействия энергии. Сохранение тумесцента какое-то время после операции достоверно уменьшает количество кровоизлияний (служит дополнительной компрессией) непосредственно после процедуры.
Существует два способа выполнения тумесцентной анестезии на магистральных венах. В первом случае тумесцент вводится перпендикулярно к коже под контролем ультразвука при помощи короткой иглы 21 G, при этом возможна различная установка датчика — продольное или поперечное по отношению к оси вены. Во время манипуляции выполняется 6—12 проколов кожи и технически осуществляется довольно просто. При втором способе используют длинные иглы 15—20 см длиной, датчик располагается поперечно по отношению к вене, при этом ведется постоянный мониторинг кончика иглы. Место первого вкола совпадает с местом первичной пункции, поэтому первый укол лишен чувствительности. Такая техника требует большего мастерства и лучшего владения ультразвуком, тем более высоки риски повреждения притоков. Но все это сторицей окупается, когда количество кожных проколов сводится к двум или трем, полностью оправдывая понятие «безболезненность процедуры». Расположение иглы должно быть как можно ближе к венозной стенке, особенно при манипуляциях в средней и нижней трети голени, когда флеболог все же решился пренебречь предостережениями насчет подкожного нерва. По мере заполнения водной подушки игла продвигается вдоль вены, причем на экране монитора постоянно должна быть видна циркулярная темная область, в центре которой определяются две светящие точки — конец иглы и световода (электрода). Самый сложный этап анестезии — область сафено-феморального соустья, так как здесь имеется наибольшее количество притоков, диаметр вены имеет наибольший размер, часто сопровождаясь веретенообразным расширением ее приустьевого отдела. Рядом находятся глубокие вены и артерии. Попавшие пузырьки воздуха из шприца затрудняют визуализацию. В принципе, уровень специалиста определяется именно в этой зоне, о чем говорит и самое большое количество рецидивов в области соустья. Перед самой процедурой термической абляции необходимо многократно в продольной и поперечной позициях проверить точность установки кончика световода (электрода). В среднем для коагуляции ствола БПВ используется 250-500 мл анестетика, МПВ - 150-250 мл.
Проведение термооблитерации начинается с придания пациенту положения Тренделенбурга (приподнятая нижняя конечность) и контроля позиции катетера, конец которого может сместиться как в одну, так и в другую сторону (отклеивание фиксирующего к коже пластыря, удлинение вены вследствие ее аневризматического расширения при анестезии). Процесс облитерации обязательно проводится под эхоконтролем, так как бывали редкие случаи отрыва кончика световода или пластмассового окончания электрода. В стандартных случаях при эндовенозной лазерной облитерации хорошо просматривается участок яркого свечения, при радиочастотной абляции картинка менее информативна, но при внимательном рассмотрении вдоль рабочей части электрода определяется легкая «дымка». После извлечения катетера немедленно проводится ультразвуковой контроль облитерированной вены — в норме ее стеки утолщаются до 0,5 см, в центре виден канал, оставленный катетером с гиперэхогенными включениями — пузырьками воздуха. На место прокола накладываются специальные пластыри (Omnistrip) или сопоставляющий шов на один день в случае экстракции вены крючками. Лечение заканчивается наложением компрессионных чулков II класса компрессии с открытым мысом для непрерывного ношения в течение 1—2 нед.
Ведение послеоперационного периода на сегодня является предметом ярких дискуссий. Часть специалистов рекомендует ношение компрессионного трикотажа не менее 1 мес, другие не признают необходимости в нем вообще (ведь вена уже коагулирована). Более «центристское» мнение — компрессия является хорошей профилактикой тромбозов глубоких вен и необходимо недельное круглосуточное ношение трикотажа в течение 7 дней. Конечно, необходимо учитывать и наличие признаков ХВН (C3—С6 классов) у ряда пациентов, которым не придется с ним расставаться и 3 и 4 мес. Такая же неясная ситуация и с профилактикой венозных тромбоэмболических осложнений. Ряд авторов сообщает об отсутствии осложнений у тысяч пациентов без всякой антикоагулянтной терапии, другие возводят применение низкомолекулярных гепаринов в стандарт лечения. Нам кажется, что при наличии отягчающих обстоятельств (ожирение, большой диаметр варикозных вен, тромбозы в анамнезе у родственников, С3-С6 классы заболевания) проведение профилактики тромбоэмболических осложнений целесообразно в течение 1-2 нед. Не вызывает разногласий необходимость в ежедневных прогулках (1,5—2 ч в день), исключение физических нагрузок. Полное возвращение к нормальной жизни возможно через 2 мес после лечения, при этом ультразвуковая картина превращения облитерированной вены в рубец формируется обычно через год.
Ошибки, опасности и осложнения эндовенозной облитерации немногочисленны, в последние годы делается усиленный акцент на проведение таких методик в условиях процедурного кабинета. Действительно, у десятков тысяч пациентов эта малоинвазивная процедура проходит «как по маслу», и нередко наступает некое «расслабление» врача, отношение к методике, как к чему-то незначительному. Наступление осложнений требует иногда быстрых и решительных действий врача, и к этому надо быть готовым заранее.
Термоиндуцированный тромбоз как следствие тромботической окклюзии БПВ или МПВ вены выше соустья является наиболее грозным осложнением термооблитерации и встречается в 5—7% случаев. Кроме ранних тромбозов, мы выявили два случая флотации тромба в общей бедренной вене через месяц и полтора после термооблитерации, которые закончились госпитализацией и тромбэктомией. Предвидеть это осложнение практически невозможно, поэтому у оперирующего врача всегда под рукой должна быть готова «дорожная карта» госпитализации больного, а также проработана тщательная система ультразвукового контроля в послеоперационном периоде.
Отрыв рабочей части световода или электрода в момент выполнения методики требует немедленной кроссэктомии, в связи с этим всегда необходим заранее приготовленный набор инструментов и бригада врачей для экстренной операции.
Отказ техники явление чаще казуистическое, однако мы столкнулись однажды с перегревом аппарата для ЭВЛК, поэтому желательно иметь второй аппарат для термооблитерации.
Длительная гиперпигментация является следствием коагуляции притоков, расположенных близко к коже, плохо выполненной тумесцентной анестезии либо неадекватной коагуляцией ствола. Чаще бывает на бедре, когда патологический сброс из БПВ происходит в приток в верхней трети бедра (h-тип строения БПВ). При такой анатомической особенности альтернативой служит минифлебэктомия притока, расположенного слишком близко к коже.
Болевой синдром, перифлебит отмечается достаточно редко и быстро снимается местным лечением в виде мазей, приемом НПВС, обезболивающих препаратов. При всем благодушии мы стали свидетелями неожиданного начавшегося перифлебита, острого целлюлита у нашей пациентки в средней трети бедра после стандартной процедуры радиочастотной абляции, который закончился массивным фиброзом размером 15x20 см. В настоящее время решается вопрос об иссечении конгломерата в стационарных условиях в связи с неудобствами при ходьбе. Наш опыт термооблитерации к тому времени был более 1,5 тыс. пациентов.
Системные реакции во время процедуры чаще всего связаны с попаданием анестетика в кровь при случайном введении его внутрипросветно. Проявляются нечеткой речью, неожиданной сонливостью, металлическим привкусом во рту и онемением кончика языка. Иногда бывают зрительные и слуховые нарушения, в худших случаях может быть потеря сознания, конвульсии вплоть до остановки сердца. Лучшей профилактикой этого служит тщательная разметка притоков перед операцией, аккуратное проведение тумесцентной анестезии. Необходимо обязательно иметь в манипуляционной противошоковый набор, а весь медицинский персонал, включая сестер, раз в 3—6 мес должен проходить практические тренинги с реаниматологами, особенно в условиях частной клиники, где поблизости нет реанимации.
Эхосклерооблитерация магистральных вен в настоящее время переживает второе рождение. Метод заключается во введении в просвет магистральной вены специальных лекарственных веществ (детергентов), вызывающих необратимые изменения в интиме сосуда с последующей облитерацией и фиброзом венозной стенки. В нашей стране популяризацией стволовой склеротера-пии в жидком виде занимается проф. Г.Д. Константинова, которая сочетает кроссэктомию с интраоперационной склеротерапией магистральных стволов. С появлением пенных форм склерозантов масштабы лечения стволовых форм варикозной болезни приняли характер эпидемии, однако ближайшие 2—3 года наблюдения за пациентами выявили до 30% рецидивов в области соустья и верхней трети бедра. Появление эндовазальных методик с применением лазера и радиоволны утвердило окончательное место стволовой эхосклеротерапии — у пожилых людей с тяжелыми сопутствующими заболеваниями, т.е. пациентам, для которых любое другое вмешательство невыполнимо. Совсем недавно появились сообщения A. Cavezzi, который достиг 98% успеха при эхосклерооблитерации магистральных вен. Автор в лечении использовал катетер, который подводил к сафено-феморальному соустью для последующего введения пены. После адекватной тумесцентной анестезии он вводил в просвет БПВ пену в дозированных количествах, одновременно извлекая катетер. Вероятно, методика в ближайшем будущем будет вновь востребована, так как не требует специальнои дорогостоящей аппаратуры, проста в исполнении и менее затратна, чем эндовенозная лазерная облитерация и радиочастотная абляция.
Операции с сохранением ствола БПВ появились с развитием ультразвуковой техники и получением новых данных о механизмах венозного сброса. На протяжении десятилетий подразумевалось, что прогрессирование варикозной болезни идет «сверху вниз», но за последние годы было установлено, что сброс может носить сегментарный характер при состоятельном терминальном и претерминальном клапане. Наконец, прогрессирование заболевания может начинаться с притоков, т.е. «снизу вверх». Так, в 1993 г. французские флебологи продемонстрировали феномен восстановления функции БПВ при сдавлении варикозного притока. Это послужило толчком к появлению органосохраняющих операций, тем более что БПВ служит отличным материалом для аортокоронарного шунтирования.
Амбулаторная селективная абляция вен под местной анестезией — изолированная флебэктомия варикозных притоков с оставлением ствола БПВ для восстановления его функции.
Метод CHIVA (Conservative Ambulatory Hemodynamic of VAricose veins — консервативное гемодинамическое лечение варикозных вен) — изменение давления в поверхностных венах за счет лигирования некоторых вен и перенаправления рефлюкса из пораженных поверхностных вен в глубокие. Разработана также во Франции К. Франчески. Учитывая, что в подавляющем большинстве развитие заболевания идет антеградно, эти методы пока не нашли широкого применения, также как и реконструкция клапанов.
Операции с устранением горизонтального рефлюкса
Сами по себе перфорантные вены не имеют очень большого значения в развитии ХЗВ, но при их несостоятельности возникает рефлюкс из глубокой венозной системы в поверхностную. С другой стороны, перфоранты представляют собой место сброса патологического венозного объема в глубокую венозную систему и после ликвидации вертикального рефлюкса может произойти их самостоятельная инволюция. Большое значение ликвидация перфорантного сброса имеет при лечении трофических язв, в остальных же случаях единого мнения пока нет. В отечественных рекомендациях показанием к лечению перфорантных вен служит точно установленный рефлюкс при дуплексном ангиосканировании в вертикальном положении пациента, когда диаметр вены превышает 3,5 мм.
С установления роли перфорантных вен Р. Линтоном и разработки им субфасциальной их перевязки мировые тенденции постоянно двигались в сторону минимизации операционной травмы. В настоящее время операция Линтона не применяется из-за ее травматичности, а на смену ей пришли следующие методы: надфасциальное лигирование через мини-разрезы под ультразвуковым контролем, склеротерапия перфорантных вен, термооблитерация (лазерная и радиочастотная), эндоскопическая диссекция перфорантных вен. Последняя применяется в настоящее время реже из-за дороговизны оборудования, отсутствия навыков у хирургов и появления новых, простых в исполнении методик.
Ряд авторов предпочитает проводить лечение перфорантных вен вторым этапом через 2—6 мес после ликвидации вертикальных сбросов если не произойдет самостоятельное восстановление их состоятельности. За такой короткий промежуток времени оставленные перфораторы не приводят к прогрессированию заболевания, но сохранят гипертензию в нелеченных притоках голени.
Минифлебэктомия притоков
Эта операция описана еще много веков назад в Римской империи, в нынешнем ее виде представлена швейцарским дерматологом Робертом Мюллером, который изготовил специальные крючки для ее выполнения. Прежде чем принять решение о проведении такой операции, необходима тщательная беседа с пациентом, осмотр и дуплексное ангиосканирование для установления причины. Очевидно, что минифлебэктомия при неустраненных патологических сбросах довольно быстро приведет к рецидиву и неудовлетворенностью пациента лечением.
Минифлебэктомия может выполняться как изолированно, так и в комбинации с основной операцией по устранению стволовых рефлюксов. Целью ее является устранение всех или большей части расширенных притоков, располагающихся над фасцией, при этом удаление расширенных более 1 см трансформированных и фиброзно-измененных притоков мало отвечает косметическим задачам и предпринимается для уменьшения патологической венозной емкости. Этому отвечает операция Нарата — тунеллирование участков в 5—10 см и удаление вены через большие разрезы по частям. Если лечение сводится к достижению высокого косметического результата, то процедура выполняется филигранно через миллиметровые проколы при помощи специальных крючков. Наиболее известны на сегодняшний день наборы Эша, Варади, Мюллера и Рамеле.
При любом варианте минифлебэктомии неоценимую помощь оказывает тумесцентная анестезия для облегчения экстракции вен, уменьшения интра-операционных кровотечений и создания дополнительной компрессии.
Противопоказаний к методике практически нет, за исключением воспалительных изменений в области операции на коже, ограничений по возрасту также не существует. Может выполняться как в стационарных, так и в амбулаторных условиях.
Техника минифлебэктомии
Проводится разметка варикозных вен стоя, которая может дополниться в лежачем положении. Перспективным представляется эхоконтролируемая визуализация притоков, дающая точную и полную информацию обо всех анатомических структурах в области операции. Тумесцентная анестезия проводится непосредственно перед вмешательством, далее выполняется прокол рядом с маркировкой кончиком остроконечного скальпеля или иглой 18 G. В него вводится крючок для минифлебэктомии, не расширяя границы, и венозная петля извлекается наружу. Вена пересекается между двумя зажимами типа «москит» и накручивается на кончик зажима, при этом перевязки вен не требуется. Таким образом, поочередно удаляются участки вены на всем протяжении, на места проколов наклеиваются склеивающие полоски, давящая повязка и компрессионный трикотаж (как правило II класса). Специального ухода в послеоперационном периоде не требуется, рекомендованы ежедневные прогулки по 1—1,5 ч в день. Контрольные осмотры проводятся через 1 и 2 нед.
Лечение осложненных форм варикозной болезни
Тромбофлебит поверхностных вен — нередкое осложнение у больных с длительным течением заболевания. При образовании тромбов в притоках процесс чаще всего протекает доброкачественно, иногда самостоятельно стихает. Встречается тромбофлебит и без варикозной болезни и в любом случае врач обязан провести тщательное обследование, в том числе и глубоких вен, для выявления его причин. Необходимо исключить травмы, онкологические заболевания, наследственные тромбофилии, сопутствующий тромбоз глубоких вен. Поражение ствола БПВ или МПВ может привести к восходящему тромбофлебиту и распространению его на глубокую венозную систему, в том числе и через перфорантные вены. Пациентам на фоне тромболизиса должно регулярно выполняться дуплексное ангиосканирование для мониторинга динамики процесса, при ухудшении картины — кроссэктомия, которую в ряде случаев рекомендуют сочетать с удалением тромбированного ствола (ликвидация и осложнения и причины). В специальной литературе появился ряд сообщений о замене кроссэктомии в подобных случаях на термооблитерацию вышерасположенных участков БПВ с хорошим результатом, но точных рекомендаций на эту тему пока нет.
Тромбоз глубоких вен может встречаться как при наличии, так и при отсутствии варикозной болезни, начинается остро и быстро приводит к фатальным последствиям в виде ТЭЛА либо к развитию посттромботической болезни. Проявляется ощущением распирания в мышцах голени, иногда резкой болью. При тромботическом поражении отдельных венозных групп голени возможно амбулаторное лечение, при генерализации процесса требуется госпитализация. Лечение проводится в зависимости от уровня тромбоза, обязательно включает тромболизис и может закончиться имплантацией кава-фильтра. В литературе обсуждается эффективность фармакомеханического и регионарного катетерного тромболизиса.
Посттромботическая болезнь
Лечение такого заболевания на сегодняшний день можно назвать симптоматическим, зависит от места и характера реканализации тромба и не может окончательно остановить прогрессирование симптомов ХВН. Пациенты вынуждены пожизненно носить компрессионный трикотаж, заниматься физиотерапией, принимать большое количество лекарств. При наступлении декомпенсации проводят попытки хирургической коррекции для восстановления или создания новых путей оттока крови, а также уменьшения венозного застоя. Для лечения этой тяжелой группы пациентов нужны узкопрофильные стационарные условия с мощной диагностической лечебной базой и высокая специализация врачей в этой области.
Консервативное лечение венозной патологии
Фармакотерапия. Основу современной терапии составляет группа биофлавоноидных препаратов (флебопротекторов), получаемых из растительного сырья или химическим путем, обладающих способностью повышать венозный тонус, а также уменьшать проявления варикозного синдрома. К ним относятся гамма-бензопироны, производные рутина, сапонины, синтетические и комбинированные препараты. Наибольший интерес представляет в настоящее время очищенная микронизированная флавоноидная фракция (МОФФ) — препарат Детралекс, доступный в двух дозировках: 500 мг и 1000 мг, содержащий 5 флавоноидов в микронизированной форме. Все входящие в состав Детралекса флавоноиды имеют не только самостоятельную фармакологическую активность, но и действуют синергично, потенцируя эффект друг друга.
Детралекс обеспечивает улучшение лимфатического дренажа. Таким образом, Детралекс является поливалентным препаратом. Среди спектра эффектов, продемонстрированных и доказанных в многочисленных исследованиях, — торможение адгезии и миграции лейкоцитов и, соответственно, защита эндотелия от агрессии лейкоцитов и зоны микроциркуляции от медиаторов воспаления, уменьшение проницаемости капилляров плюс улучшение реологических свойств крови. Таким образом, реализуется вено-специфическое противовоспалительное действие Детралекса, которое позволяет, как показали экспериментальные и клинические работы, устранить на ранних стадиях транзиторный рефлюкс, а значит влиять на предупреждение прогрессирования ХЗВ. Более того, многими исследователями Детралекс считается в настоящее время препаратом выбора для консервативного лечения во флебологии, что подкреплено позицией данного препарата в Российских и Международных рекомендациях по лечения ХЗВ. В 2006 г. было проведено исследование ДЕФАНС, которое показало, что назначение в стандартной дозе Детралекса после комбинированной флебэктомии снижает интенсивность болевого синдрома в раннем послеоперационном периоде, выраженность послеоперационных гематом и улучшает качество жизни пациентов. Позднее в ряде работ показана эффективность терапии Детралекса в стандартной дозе в снижении интенсивности болевого синдрома, частоты повторных «венозных» симптомов, улучшения качества жизни пациентов после термооблитерации.
Длительность приема препарата может составлять до 1 года, но индивидуальна и всегда обсуждается с лечащим врачом.
В консервативном лечении хронических заболеваний вен ключевую роль играет компрессионная терапия. Она уменьшает ретроградный кровоток, способствует устранению патологической венозной емкости, снижает транссудацию крови из сосудистого русла, улучшает лимфоотток и обеспечивает лечение трофических нарушений (классы С4—С6).
Компрессия может носить временный (после операции, склеротерапии) или постоянный характер (ХВН, посттромботическая болезнь), осуществляться при помощи бинтования или специального трикотажа, который несравненно удобнее. Кроме того, для адекватного бинтования необходимо обучение или постоянный контроль врача, степень компрессии при этом не регулируется. Компрессионный трикотаж бывает четырех классов, в зависимости от давления на уровне лодыжки:
- I класс — 18—21 ммрт.ст.;
- II класс — 23—32 мм рт.ст.;
- III класс — 34—46 мм рт.ст.;
- IV класс — более 49 мм рт.ст.
Подбор трикотажа зависит от предполагаемых целей. Если это состояние после термооблитерации БПВ или склеротерапии на бедрах, то требуются чулки до паха, при использовании трикотажа в профилактических целях достаточно одевать гольфы для улучшения работы мышечно-венозной помпы.
Фирмы-производители выпускают в настоящее время различные компрессионные изделия, назначать тот или иной вид трикотажа должен только врач. Правильно подобрать изделие по размерам помогут в лечебном учреждении либо в специализированных ортопедических салонах.
Физиотерапевтические процедуры в сочетании с компрессионной и фармакотерапией входят в необходимый комплекс лечения и профилактики ХЗВ. Для снятия отека и улучшения микроциркуляции широко используется переменная пневмокомпрессия, очень перспективным направлением может стать интервальная вакуумная терапия нижней половины тела (Вакумед).
